Cette méthode décrit le prélèvement Actif sur cassette avec filtres imprégnés ; cartouche de silice imprégnée et l'analyse par spectrophotométrie ; HPLC phase inverse détection UV de la (des) substance(s) : Acide peracétique et peroxyde d'hydrogène
Données de validation : Validation partielle
Substances
Informations générales
Propriétés physico-chimiques
| Nom | N° CAS | Formule chimique | Classification CMR |
|---|---|---|---|
| Acide peracétique | 79-21-0 | C2H4O3 |
|
| Peroxyde d'hydrogène | 7722-84-1 | H2O2 |
|
Plus d'informations
| Nom | Masse molaire | Densité | Synonymes | Fiche toxicologique |
|---|---|---|---|---|
| Acide peracétique | 76,05 | 1,15 | ||
| Peroxyde d'hydrogène | 34,01 | Eau oxygénée |
Principe et informations
Cette méthode permet de doser l'acide peracétique et le peroxyde d'hydrogène, ces deux substances étant présentes simultanément lors de l'utilisation des solutions de stérilisation à froid (industries alimentaires ou milieu hospitalier).
Un filtre imprégné d'oxysulfate de titane retient sélectivement le peroxyde d'hydrogène. L'acide peracétique quant à lui peut-être prélevé sur gel de silice basique imprégné de méthyl-p-tolylsulfoxyde (MTSO).
Après désorption immédiate des filtres, le complexe coloré Ti-H2O2 est dosé par spectrophotométrie visible. Les produits des réactions d'oxydation (MTSOO sur le gel de silice) sont analysés par chromatographie en phase liquide.
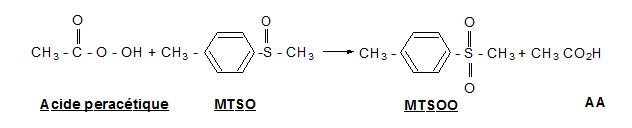
Principe de prélèvement et d'analyse
-
État physique
Aérosols (mélange de gaz ou vapeurs / particules) -
Type de prélèvements
Actif -
Nom du dispositif
cassette avec filtres imprégnés ; cartouche de silice imprégnée -
Plus d'informations
Réactifs
- ACETONITRILE
- ACIDE SULFURIQUE
- CARBONATE DE SODIUM
- EAU
- ETHANOL
- METHANOL
- METHYL-p-TOLYLSULFOXYDE(MTSO)
- METHYL-p-TOLYSULFONE (MTSOO)
- OXYSULFATE DE TITANE
- PEROXYDE D'HYDROGENE
Méthode de prélèvement
Deux dispositifs de prélèvement (en série) :
Dispositif N°1
-
Type dispositif
CASSETTE 25 mm 2 pièces -
Support ou substrat de collecte
- 2 FILTRES EN FIBRE DE QUARTZ IMPREGNES
-
Préparation du substrat
Solution d'imprégnation : 2,1 g d'oxysulfate de titane dans 25 mL d'acide sulfurique 1,8 M. Chauffer sous agitation jusqu'à obtention d'une solution limpide. Après refroidissement ajouter à 25 mL d'eau et jauger à 50 mL
Imprégner les filtres par deux à l'aide de 210 µL de solution. Sécher à l'étuve pendant 2 heures à 60 °C
-
Commentaires, conseils et consignes
Deux filtres imprégnés sont déposés au fond de la cassette.
Dispositif N°2
-
Type dispositif
CARTOUCHE en VERRE 3 mL -
Support ou substrat de collecte
- GEL DE SILICE IMPREGNE
-
Quantité de support dans la plage de mesure (mg)
800 -
Préparation du substrat
Mélanger 200 g de gel de silice (0,2-0,5 mm) à une solution de carbonate de sodium (106 g de Na2CO3 dans 400 mL d'eau). Sécher ensuite le gel de silice à l'étuve à 140°C pendant 15 heures, le broyer puis le tamiser (0,25 mm <diamètre< 0,5 mm).
Préparer la solution d'imprégnation par dissolution de 154 mg de MTSO dans 50 mL de méthanol. Ajouter à 50 g de gel de silice basique contenu dans un ballon, 50 ml de la solution d'imprégnation. évaporer le méthanol sous vide à température ambiante.
Les cartouches SPE sont remplies avec environ 800 mg de gel de silice imprégné, maintenu par deux frittés en Téflon.

Schéma du dispositif en série
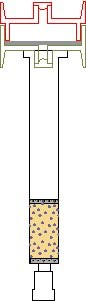
Conditions de prélèvement
-
Débit de prélèvement (L/min)
1 -
15 minutes (VLEP-CT possible dans ces conditions)
oui -
Temps de prélèvement maximum en heures
8
Pompe de prélèvement
- Pompe à débit de 1 à 3 L/min
Conditionnement particulier
-
Choix conditionnement particulier
désorption immédiate
Compléments
Les filtres devront être utilisés dans les 4 semaines après leur imprégnation.
Les filtres doivent être désorbés immédiatement après le prélèvement.
Préparation des dispositifs de prélèvement en vue d’une intervention en entreprise
Méthode d'analyse
Principe général de l'analyse en laboratoire
Préparation d'analyse
-
Conditions de conservation avant analyse
Les filtres doivent être désorbés par 5 mL d'acide sulfurique (1M) immédiatement après le prélèvement.
Le gel de silice peut être conservé au moins 8 jours après le prélèvement.
-
Séparation des dispositifs
oui -
Nombre d'étapes de préparation
2 -
Commentaires sur les étapes
La première étape décrit la traitement des cassettes.
La deuxième étape décrit le traitement des cartouches de gel de silice.
-
Durée de conservation échantillon préparé avant analyse
1 mois -
Conditions de conservation échantillon préparé avant analyse
Les solutions de désorption sont stables environ un mois.
2 étapes de préparation :
Étape de préparation N°1
-
Solvant ou solution
- ACIDE SULFURIQUE
-
Type de préparation
Percolation -
Volume
5 mL -
Autres conditions de préparation
Immédiatement après prélèvement, les 2 filtres sont désorbés directement dans la cassette par percolation
de 5 mL d'H2SO4 (1 M). Récupérer la totalité du solvant par refoulement à l'aide d'une seringue ou déterminer le volume exact de solvant utilisé (par pesée du flacon de recueil avant et après percolation).
Étape de préparation N°2
-
Solvant ou solution
- ACETONITRILE
- ELUANT
-
Type de préparation
Percolation -
Volume
10 mL -
Autres conditions de préparation
Les tubes sont désorbés par percolation de 5 mL d'acétonitrile pur. La solution de percolation obtenue est ensuite diluée avec 5 mL d'éluant utilisé pour l'analyse chromatographique.
Remarque
Traiter les blancs de terrain et les blancs de laboratoire de la même façon.
Deux conditions analytiques :
Condition analytique N°1
-
Technique analytique
- SPECTROPHOTOMETRIE
-
Commentaires, conseils ou condition particulières
ʎ : 410-415nm.
Condition analytique N°2
-
Technique analytique
- CHROMATOGRAPHIE EN PHASE LIQUIDE
-
Injecteur
- PASSEUR AUTOMATIQUE
-
Colonne
- PHASE INVERSE C18
-
Détecteur
- ULTRAVIOLET (UV)
-
Phase mobile
- ACETONITRILE
- EAU TAMPONNEE
Étalonnage et expression des résultats
La méthode d'étalonnage indiquée est celle utilisée lors du développement. Elle n'a cependant pas de caractère obligatoire
-
Principe d'étalonnage
externe -
Solvant de l’étalon
- ACETONITRILE
- ACIDE SULFURIQUE
- EAU
- ELUANT
-
Commentaires
Dosage du peroxyde d'hydrogène
Réaliser une gamme d'étalonnage dans la même matrice que les échantillons à analyser. La réponse est linéaire jusqu'à une concentration de 30 mg/L de H2O2.
Dosage de l'acide peracétique
L'étalonnage externe est pratiqué avec des étalons réalisés à partir d'une solution de méthyl-p-tolylsulfone (MTSOO).
Pour le dosage des solutions de désorption des tubes de gel de silice, préparer une solution-mère de méthyl-p-tolylsulfone (MTSOO) dans le méthanol, puis une série de solutions étalons par dilution de cette solution-mère dans l'éluant.
-
Calcul de la quantité de substance sur le dispositif
Pour le calcul de la concentration atomsphèrique en peroxyde d'hydrogène, se référer au lien ci dessus.
La concentration atmosphèrique en acide peracétique dans l’atmosphère est donnée par :
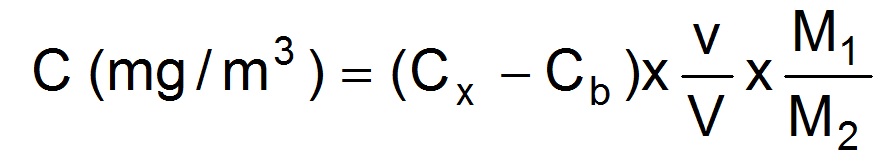
avec : Cx (mg/L) : concentration de MTSOO dans la solution échantillon analysée
Cb (mg/L) : moyenne des concentrations de MTSOO dans les blancs de laboratoire
v (mL) : volume de la solution analysée
V (L) : volume d’air prélevé
M1 (g/mol) : masse moléculaire de l'acide peracétique
M2 (g/mol) : masse moléculaire de la méthyl-p-tolyl sulfone (MTSOO).
Compléments
Voir exemple de condition chromatographique dans données de validation - complément
Bibliographie
- F. GAGNAIRE, B. MARIGNAC, G. HECHT and M. HERY - Sensory Irritation of Acetic Acid, Hydrogen Peroxyde, Peroxyacetic acid and their Mixture in Mice. Ann. occup. Hyg., 2002, vol. 46, n°1, pp. 97-102,.
- S. EFFKENMANN et al. - Determination of gas phase peroxyacetic acid using pre-column derivatization with organic sulfide reagents and liquid chromatography. Journal of chromatography A. 855 (1999), pp. 551-561.
- C. S. CHRISTENSEN et al. - Determination of hydrogen peroxide in workplace air: interferences and method validation. J. Environ. Monit., 2000, 2, pp. 339-343.
- G. HECHT et al. - Workplace monitoring of hydrogen peroxyde using titanyl-coated sorbents. J. Environ. Monit., 1999, 1, pp. 149-152.
Historique
| Version | Date | Modification(s) faisant l’objet | Paragraphes |
|---|---|---|---|
| 068 | Jusqu’au 28/11/07 | Création et mises à jour |
|
| 068/V01 | 28/11/07 | Nouvelle présentation |
|
| 068/V01.01 | 31/01/09 | Remplacement de la notation VLE par VLCT Description de la cartouche SPE | Substances mesurables Echantillonneur (PRELEVEMENT) |
| 068/V01.02 | 15/07/2013 | Révision de la terminologie | Tous |
| M-214/V01 | Novembre 2015 | Mise en ligne 2 Substances présentent simultanément Prélèvement sur cassette + cartouche de gel de silice Analyse par spectrophotométrie |
Date de mise à jour : novembre 2015
Ancien numéro de fiche MétroPol : 068
