Prélèvement : Actif sur CIP10-I
Analyse : UPLC/MS/MS
Données de validation : Validation complète
Substances
Informations générales
Propriétés physico-chimiques
| Nom | N° CAS | Formule chimique | Classification CMR |
|---|---|---|---|
| 4-Déoxynivalénol | 51481-10-8 | C15H20O6 |
|
| Aflatoxine B1 | 1162-65-8 | C17H12O6 |
|
| Aflatoxine B2 | 7220-81-7 | C17H14O6 |
|
| Aflatoxine G1 | 1165-39-5 | C17H12O7 |
|
| Aflatoxine G2 | 7241-98-7 | C17H14O7 |
|
| Fumonisine B1 | 116355-83-0 | C34H59NO15 |
|
| Fumonisine B2 | 116355-84-1 | C34H59NO14 |
|
| HT2 toxine | 26934-87-2 | C22H32O8 |
|
| Mélange de mycotoxines |
|
||
| Ochratoxine A | 303-47-9 | C20H18ClNO6 |
|
| T2 toxine | 21259-20-1 | C24H34O9 |
|
| Zéaralénone | 17924-92-4 | C18H22O5 |
|
Plus d'informations
| Nom | Masse molaire | Densité | Synonymes | Fiche toxicologique |
|---|---|---|---|---|
| 4-Déoxynivalénol | 296 | DON | ||
| Aflatoxine B1 | 312 | Afla B1 | ||
| Aflatoxine B2 | 314 | Afla B2 | ||
| Aflatoxine G1 | 328 | Afla G1 | ||
| Aflatoxine G2 | 330 | Afla G2 | ||
| Fumonisine B1 | 722 | FB1 | ||
| Fumonisine B2 | 706 | FB2 | ||
| HT2 toxine | 424 | HT2 | ||
| Mélange de mycotoxines | ||||
| Ochratoxine A | 404 | OTA | ||
| T2 toxine | 470,5 | T2 | ||
| Zéaralénone | 318,4 | ZEA |
Familles de substances
- AGENTS BIOLOGIQUES
- BIOAEROSOLS
- MYCOTOXINES
Principe et informations
- Classification CIRC et dose journalière tolérable (DJT) des mycotoxines (cf ED 4411):
| Mycotoxines | Classification CIRC | DJT (µg/kg pc*) |
| DON | Groupe 3 | 1 |
| Somme des aflatoxines | Groupe 1 | Principe Alara (Aussi bas que raisonnablement possible) |
| Somme des fumonisines | Groupe 2B | 1 |
| Somme des toxines HT2 et T2 | Groupe 3 | 0,02 |
| Ochratoxine A | Groupe 2B | 5 |
| Zéaralénone | Groupe 3 | 0,25 |
* Par kilogramme de poids corporel
- La mycotoxine déoxynivalénol (DON) ou vomitoxine, appartient aux trichothécènes de la classe B, qui sont produites, en particulier, par des moisissures appartenant au genre Fusarium. Des niveaux élevés de ces mycotoxines sont rapportés, en présence de zéaralénone, dans les grains de blé, d'orge, d'avoine, de maïs et de riz au cours des années pluvieuses (pendant la période de floraison des céréales). Le DON survit tout à la fois aux processus de cuisson et de brassage.
- Les mycotoxines HT2 et T2 appartiennent à la famille des trichothécènes de type A, produites par certaines souches de moisissures Fusarium qui se développent sur les céréales dans les régions au climat froid ou tempéré et dans des conditions de stockage humides.
Dans l'Union européenne, les valeurs maximales des mycotoxines dans les produits agricoles et alimentaires sont fixées par les directives européennes du 8 et 9 avril 2024 - (EU) 2024/1022 et (EU) 2024/1038 :
| Denrées | Valeurs maximales admissibles (µg/kg) | |||||
| DON | Somme des aflatoxines | Somme des fumonisines | Somme des toxines HT2 et T2 | Ochratoxine A | Zéaralénone | |
| Arachides, noix, fruits séchés | / | 4 | / | / | 2-10 | / |
| Céréales brutes | 1250-1750 | 4 | 4000 | 50-1250 (avoine) | 5 | 100 |
| Céréales destinées à la consommation | 750 | 4 | 1000 | 20-100 | 3 | 75 |
| Maïs et aliments à base de maïs | 1250 (brut) | 10 | 800-1000 | 50 | / | 100 |
| Café | / | / | / | / | 3-5 | / |
| Aliments pour bébés | 150 | 0,1 | 200 | 10 | 0,5 | 20 |
- La détermination des concentrations en aflatoxines, ochratoxine A, fumonisines B1 et B2, DON, zéaralénone, T2 et/ou HT2 dans les atmosphères de travail est réalisée par prélèvement de l’aérosol de poussières contaminées à l’aide d’un échantillonneur CIP 10 muni d’un sélecteur de la fraction inhalable haute efficacité, équipé d’une coupelle rotative contenant une mousse filtrante en polyuréthane préalablement lavée (voir dispositif de prélèvement). La masse d'aérosol prélevé peut être déterminée par pesée des coupelles avant et après prélèvement. L'intérêt de cette méthode réside dans l'utilisation de 2 colonnes d'immunoaffinité (IAC) multi-mycotoxines utilisées en tandem (deux colonnes AOF et DZT montées en série), qui permet l’analyse de l'une ou l'autre des 11 mycotoxines sur un même prélèvement d'air, sans avoir à faire le choix a priori de la mycotoxine à doser. Le protocole de préparation des échantillons tient compte de toutes les contraintes dues à l’utilisation des ces colonnes d'IA.
Avertissement : Pour les aflatoxines, le niveau de performances validé expérimentalement reste en deçà de celui estimé pour la méthode individuelle M-45. Dans ce cas, la méthode multi-mycotoxines pourra constituer une 1ère étape vers un dosage plus précis réalisé, au besoin, sur un autre prélèvement d’air, analysé à l’aide d’une colonne IA spécifique.
Principe de prélèvement et d'analyse
-
État physique
Particules en suspension (liquides ou/et solides) -
Type de prélèvements
Actif -
Nom du dispositif
CIP10-I -
Plus d'informations
-
Technique analytique
CHROMATOGRAPHIE LIQUIDE ULTRA HAUTE PERFORMANCE -
Injecteur
PASSEUR AUTOMATIQUE -
Détecteur
SPECTROMETRE MS/MS
Domaine d'application
| Substance | Quantité minimum sur le dispositif | Quantité maximum sur le dispositif | Concentration minimum | Concentration maximum | Volume maximum |
|---|---|---|---|---|---|
| 4-Déoxynivalénol | 2,70 ng |
375 ng |
|||
| Aflatoxine B1 | 0,50 ng |
45 ng |
|||
| Aflatoxine B2 | 0,50 ng |
15 ng |
|||
| Aflatoxine G1 | 0,39 ng |
45 ng |
|||
| Aflatoxine G2 | 0,39 ng |
36 ng |
|||
| Fumonisine B1 | 2,04 ng |
375 ng |
|||
| Fumonisine B2 | 2,05 ng |
375 ng |
|||
| HT2 toxine | 2,77 ng |
188 ng |
|||
| Mélange de mycotoxines | 1 mg |
60 mg |
|||
| Ochratoxine A | 0,26 ng |
72 ng |
|||
| T2 toxine | 2,74 ng |
380 ng |
|||
| Zéaralénone | 2,72 ng |
376 ng |
Réactifs
- ACETONITRILE
- ACIDE FORMIQUE
- EAU
- METHANOL
- SOLUTION COMMERCIALE PBS pH 7,4
Méthode de prélèvement
Un dispositif de prélèvement :
Dispositif N°1
-
Type dispositif
CIP10-Inhalable -
Support ou substrat de collecte
- FILTRE EN MOUSSE POLYURETHANE
-
Préparation du substrat
Les mousses filtrantes en polyuréthane sont préalablement lavées dans de l'eau savonneuse tiède et pressées plusieurs fois pendant le lavage. Répéter ces étapes avec de l'eau ultra pure puis avec de l'acétonitrile en réalisant 3 rinçages et en pressant les mousses plusieurs fois pendant le lavage. Laisser sécher à température ambiante sous sorbonne.
Conditionner les mousses et les coupelles et réaliser la pesée avant et après prélèvement, suivant la méthode décrite dans la fiche "Analyse gravimétrique", pour déterminer la masse des poussières collectées.
Nota : le prélèvement est validé pour des quantités de poussières dans les coupelles comprises entre 1 mg (en deçà, dosages < limites de quantification des mycotoxines) et 60 mg (au-delà, perte d’efficacité de collecte du CIP10).
-
Commentaires, conseils et consignes

Photo d'un ensemble CIP10-I et représentation schématique du sélecteur de la fraction inhalable avec la coupelle rotative en place.
Conditions de prélèvement
-
Débit de prélèvement (L/min)
10 -
Temps de prélèvement maximum en heures
8
Préparation des dispositifs de prélèvement en vue d’une intervention en entreprise
Méthode d'analyse
Principe général de l'analyse en laboratoire
Préparation d'analyse
-
Durée de conservation prélèvements avant analyse
30 jour(s) -
Conditions de conservation avant analyse
A température ambiante.
-
Nombre d'étapes de préparation
5 -
Commentaires sur les étapes
Réaliser préalablement les pesées des coupelles après prélèvement. Ensuite :
- La première étape consiste à extraire les poussières collectées dans les coupelles, avec un mélange méthanol/eau 70/30 (V/V).
- La deuxième étape consiste à diluer avec une solution de tampon phosphate (PBS).
- La troisième étape consiste à fixer et purifier les mycotoxines, sur deux colonnes d'immunoaffinité montées en série, AOF (Afla, Ochra, Fumo) et DZT (DON, Zea, Toxi) contenant respectivement les anticorps monoclonaux de 4 aflatoxines, de l'ochratoxine A et de la fumonisine B1 d'une part, du DON, de la zéaralénone, et des toxines T2 et HT2 d'autre part, greffés sur gel de Sépharose. Ces colonnes doivent être stockées non congelées entre 4 °C et 8°C, et utilisées à température ambiante.
- La quatrième étape consiste à récupérer les mycotoxines des colonnes AOF/DZT en éluant par 2 mL de méthanol.
- La cinquième étape est une concentration à sec de l’éluat précédent sous flux d'azote.
-
Durée de conservation échantillon préparé avant analyse
8 jour(s) -
Conditions de conservation échantillon préparé avant analyse
Conservation à 4 °C.
5 étapes de préparation :
Étape de préparation N°1
-
Solvant ou solution
- MELANGE DE SOLVANTS
-
Type de préparation
Extraction -
Volume
13 mL -
Ultrasons
- Temps d'ultrasons : 15 min
-
Commentaires
Extraction des poussières collectées dans la coupelle CIP10 (mousse et parois):
- Transférer la mousse dans un flacon de 20 mL avec 10 mL du solvant de désorption (méthanol/eau 70/30).
- Extraire aux ultra-sons pendant 15 minutes.
- Récupérer les poussières déposées sur les parois de la coupelle par ajout de 3 * 1 mL du solvant de désorption dans la coupelle, la refermer avec son couvercle et la soumettre 15 minutes aux ultra-sons également.
- Transférer la totalité de la solution d’extraction à l’aide d’une pipette pasteur en matière plastique dans un flacon de 200 mL.
Étape de préparation N°2
-
Solvant ou solution
- Tampon phosphate
-
Type de préparation
Dilution -
Volume
160 mL -
Filtration
Au besoin
-
Commentaires
Dilution par 160 mL de solution tampon phosphate (pH 7,4) (PBS) pour qu’au final la proportion de solvant organique reste < 5% de sur les colonnes IAC (selon les préconisations du fournisseur) :
- Diluer la solution d'extraction par 160 mL de tampon PBS (en plusieurs fois, parmi lesquelles celles qui servent à rincer le flacon de 20 mL qui contenait la mousse et la coupelle vide et en aspirant systématiquement le tampon au travers de la mousse, à l'aide de la pipette pasteur).
- Agiter à l’aide d’un barreau magnétique.
- Si la solution est très chargée en poussières, prévoir une filtration au travers d’un cône en papier filtre.
Étape de préparation N°3
-
Solvant ou solution
- PBS
-
Type de préparation
Purification -
Commentaires
- Laisser chaque colonne (AOF ou DZT) se stabiliser à température ambiante pendant 20 minutes puis éliminer la solution de stockage par simple gravité dans une cuve de récupération prévue à cet effet.
- Conditionner chaque colonne IA selon les préconisations du fournisseur.
- Associer les colonnes d’immunoaffinité en tandem, la colonne AOF au-dessus de la colonne DZT, avec un embout adapté à l’entrée de chacune des 2 colonnes. Remplir chaque colonne de PBS.
- Prévoir un corps de seringue de 20 ou 50 mL comme réservoir de distribution, à remplir en plusieurs fois, et transférer tout le volume de solution échantillon sur la colonne (voir photo 1).
- Amorcer si besoin l’élution, en douceur, à l’aide d’une pipette Pasteur en verre ou à l’aide d’un faible vide, sans dépasser 5 bars.
- Eliminer le mélange de solvant par soutirage sous vide dans la cuve de récupération, sans amener à sec.
- Les mycotoxines sont maintenant liées aux anticorps monoclonaux spécifiques, présents sur l’une ou l’autre des 2 colonnes.
- Rincer les colonnes IA avec 2 fois 10 mL d’eau, préalablement versés dans le flacon de 200 mL ayant contenu la solution échantillon (pour une récupération complète de celle-ci).
- Eliminer le liquide par soutirage à sec, en douceur et en s’assurant qu’il soit complet.
Photo 1
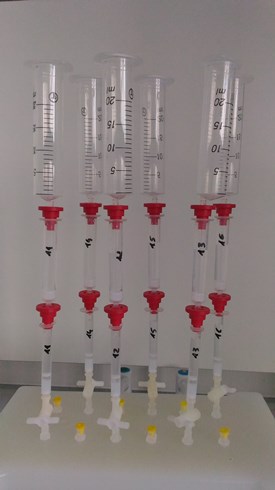
Étape de préparation N°4
-
Solvant ou solution
- METHANOL
-
Type de préparation
Extraction -
Commentaires
Nota : Pour une plus grande précision de l’analyse, les récupérations en flacons, les transferts et les dilutions décrits à partir de cette 4°étape, pourront être réalisés par gravimétrie (sur une balance calibrée) :
Pesée flacon avec bouchon,
Puis, pour les dilutions
Pesée flacon bouché + solvant
Pesée flacon bouché + solvant + solution mycotoxine
Ou, pour les reprises après évaporation à sec
Pesée flacon bouché + solution de reprise,
Etc.
- Tarer au besoin les flacons de 4 mL, prévus pour la récupération de l’extrait, en identifiant chaque flacon et le bouchon associé.
- Remplacer la cuve de récupération par le portoir équipé des flacons de récupération et s’assurer que les aiguilles plongent jusqu’au fond des flacons.
- Déposer 2 mL de méthanol à l’entrée de la colonne AOF, laisser passer au-travers des deux colonnes par gravité, recueillir dans le flacon.
- Récupérer la totalité de l’éluat par soutirage à sec, en douceur et en s’assurant qu’il soit complet, mais sans excès sous peine d’éclaboussures et de perte de produit.
La pesée du volume récupéré permet de vérifier que tout le méthanol a bien été élué des colonnes IA.
Étape de préparation N°5
-
Solvant ou solution
- MELANGE MeOH/EAU 50/50
-
Type de préparation
Concentration -
Évaporation
- Température : 35 °C
- Gaz : Azote
-
Commentaires
L’extrait contenu dans les flacons de récupération est évaporé à sec sous flux d’azote de la façon suivante :
- Déposer les flacons, sans leur bouchon, dans les blocs de l’évaporateur prévu à cet effet (T=35°C, débit d’azote 0,4 PSI) (Voir photo 2).
- Faire descendre les aiguilles au-dessus des flacons sans qu’elles ne trempent dans l’extrait.
- Effectuer cette étape de concentration pendant 1 heure à 1 heure 30.
- Descendre les aiguilles au fur et à mesure de l’évaporation.
Lorsque l’extrait est complètement évaporé :
- Retirer les flacons, remettre leur bouchon et effectuer la pesée du flacon contenant le résidu sec ;
- Reprendre le résidu par 500 μL de méthanol/eau 50/50 et effectuer la pesée du flacon "plein" ;
La solution obtenue est ainsi concentrée 4 fois par rapport à l’éluat IAC.
- Mélanger à l’aide d’un agitateur Vortex et transférer dans un flacon pour passeur muni d’un insert.
Photo 2

Une condition analytique :
Condition analytique N°1
-
Technique analytique
- CHROMATOGRAPHIE LIQUIDE ULTRA HAUTE PERFORMANCE
-
Injecteur
- PASSEUR AUTOMATIQUE
-
Colonne
- PHASE INVERSE INERTE
-
Détecteur
- SPECTROMETRE MS/MS
-
Phase mobile
- EAU+0.1%ACIDE FORMIQUE
- METHANOL+0.1%ACIDE FORMIQUE
Étalonnage et expression des résultats
La méthode d'étalonnage utilisée lors du développement de la méthode revêt un caractère obligatoire pour atteindre le niveau de performances validé (sensibilité, rendements, précision)
-
Principe d'étalonnage
externe -
Solvant de l’étalon
- Même solvant que celui des échantillons
-
Commentaires
Les solutions étalons sont préparées par mélange des 8 solutions-mères des produits de référence (aflatoxines, ochratoxine A, fumonisines B1 et B2, DON, zéaralénone, T2, HT2), dilutions du mélange, purification sur colonne d’immunoaffinité AOF-DZT et concentration, dans les mêmes conditions que celles adoptées pour les échantillons prélevés dans l’air.
Les informations détaillées sur l'étalonnage sont fournies avec les données de validation.
-
Calcul de la quantité de substance sur le dispositif
1- Déterminer la concentration (Ca) en mycotoxine(s) de chaque aliquote analysée :
Etablir une droite d’étalonnage pour chacune des mycotoxines (Afla G1, Afla G2, Afla B1, Afla B2, OTA, FB1, FB2, Zéa, Don, HT2 et T2) en prenant en compte les concentrations exactes (Ee) des étalons injectés.
Les concentrations en l’une ou l’autre des mycotoxines, Ca (ng/mL), dans les aliquotes-échantillons analysées, sont déterminées à partir de chacune des droites d’étalonnage.
2- Calculer la quantité (Mp) extraite sur tandem AOF-DZT :
- Mp (ng, selon la mycotoxine) = Ca x Vr
avec Vr (mL) : volume de reprise après évaporation à sec;
Ca (ng/mL) : concentration en mycotoxine de la solution échantillon analysée
La quantité (Mp) est égale à la quantité de mycotoxine prélevée dans la coupelle du CIP10.
Calcul de la concentration (C) dans l'air
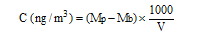
avec : Mp (ng) : masse de mycotoxine dans la coupelle de prélèvement
Mb (ng) : masse moyenne de la mycotoxine dans les blancs de laboratoire
V (L) : volume d'air prélevé.
Il est également possible de calculer la concentration pondérale des poussières contaminées dans l’air
1- Masse des poussières Q (en mg) prélevées dans la coupelle x.
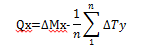
avec, pour n témoins pesés :
Mix : la masse initiale de la xe coupelle utilisée
Mfx : la masse finale de la xe coupelle utilisée
ΔMx : Mfx - Mix, pour la xe coupelle utilisée
Tiy : la masse initiale de la ye coupelle témoin
Tfy : la masse finale de la ye coupelle témoin
ΔT : Tfy - Tiy pour le ye témoin.
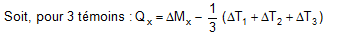
2- Teneur moyenne en chacune des mycotoxines dans les poussières Q (en µg/kg) :
La contamination des poussières dans l’aérosol peut alors être estimée pour chacune des mycotoxines :
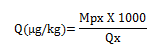
avec Mpx (ng) : masse de la mycotoxine dosée dans la coupelle x
Qx (mg) : quantité de poussières prélevée dans la coupelle x.
Compléments
Une procédure de décontamination de la verrerie et des paillasses (en cas de renversement d’un flacon) devra être établie, avec un lavage à l’hypochlorite de sodium suivi d’un lavage à l’acétone, et d’un rinçage à l’eau puis de la vaisselle habituelle.
Parmi les différentes méthodes chimiques utilisées en vue de décontaminer les aliments, les plus efficaces vis-à-vis de la zéaralénone semblent être l'emploi de formaldéhyde, puis d'hydroxyde d'ammonium.
Les solutions de décontamination seront éliminées dans un bidon de récupération pour produits chimiques prévu à cet effet.
Se reporter à : Manipulations dans les laboratoires de chimie
Historique
| Version | Date | Modification(s) faisant l'objet de la nouvelle version |
|---|---|---|
| M-460/V-01 | Mai 2025 | Création |
Date de mise à jour : octobre 2025
