Pathologie - Toxicologie
-
Toxicocinétique - Métabolisme [19, 20]
Le dioxyde de soufre est bien absorbé par voie respiratoire et rapidement hydraté en acide sulfureux. Celui-ci est distribué largement dans l'organisme où il est majoritairement métabolisé par le foie en sulfates, qui sont éliminés dans les urines.
Chez l'animal
Absorption
Le dioxyde de soufre pénètre dans l'organisme par inhalation, avec un taux d’absorption de 90-95 % chez le lapin[14].
L'absorption est fonction de la concentration : chez le lapin, plus de 90 % est absorbé à forte concentration (≥ 100 ppm) et environ 40 % pour des concentrations inférieures à 0,1 ppm [15] ; des résultats semblables sont observés chez le chien.
Distribution
En raison de l'hydratation rapide du dioxyde de soufre, ces interactions avec les molécules biologiques en milieu aqueux sont probablement celles des ions sulfite et bisulfite formés ; c'est pourquoi, certaines expositions par voie orale ont été menées avec ces composés.
Chez le chien, à la suite d’une exposition à du 35SO2 par voie inhalatoire, la radioactivité est principalement retrouvée dans la trachée, les bronches, les poumons et les ganglions lymphatiques, et dans une moindre mesure dans les reins, l’œsophage, les ovaires et les autres tissus [16].
Le SO2 peut être généré de manière endogène chez les mammifères à partir d’acides aminés contenant du soufre, notamment la L-cystéine [17].
Métabolisme
Les métabolismes de l’Homme et de l’animal sont similaires. Après avoir été transformés en sulfites, ces derniers sont oxydés en sulfates par la sulfite oxydase, principalement dans le foie. Sous cette forme, le métabolite est incorporé à la réserve corporelle de sulfates. Il y a de grandes différences d'activité de la sulfite oxydase entre les espèces, le rat ayant l’activité la plus élevée et le lapin la plus faible.
Schéma métabolique
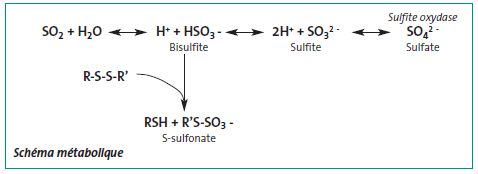
Excrétion
Le dioxyde de soufre est éliminé essentiellement sous forme de sulfate dans les urines (92 % chez le chien) [18].
Mode d'actions [25]
Le SO2 est fortement régulé chez les mammifères pour maintenir l'homéostasie. Les effets physiologiques du SO2 comprennent la régulation du tonus vasculaire (effet vasodilatateur), ils agissent sur les canaux calciques, la fonction cardiaque et le métabolisme des lipides, tandis que les effets physiopathologiques sont principalement liés à son effet oxydant, l'inflammation ou l’apoptose cellulaire.
Le SO2 endogène a des effets antioxydants, anti-inflammatoires, hypotenseurs et anti-athérogènes.
Toxicité expérimentaleToxicité aiguë
Le dioxyde de soufre produit une irritation sévère de la muqueuse du tractus respiratoire avec lésions cellulaires et œdèmes laryngo-trachéal et pulmonaire. Il provoque de graves lésions irréversibles pour la peau et les yeux.
Le dioxyde de soufre est un gaz toxique par inhalation. La CL50 est de 1260 ppm/4 h chez le rat et 1060 ppm/ 4 h chez la souris.
Les symptômes observés traduisent essentiellement une action au niveau du système respiratoire.
À faible concentration, le dioxyde de soufre est un gaz irritant au niveau du nez et des voies aériennes supérieures ; il provoque des lésions de la cavité nasale (souris, 10 ppm/72 h), une bronchoconstriction (cobaye, 0,2 ppm/1 h) et une production accrue de mucus [26].
En plus des effets sur le système respiratoire, on observe des modifications hématologiques : hémolyse, augmentation de l'hématocrite et du taux de sulfhémoglobine, une baisse de la viscosité du sang total (rat, ≈ 1 ppm/24 h) [27, 28].
À des concentrations plus élevées (rat, 800 ppm, 8 h), une réponse plus sévère au niveau de l'épithélium trachéal peut survenir avec des groupes de cellules détachées, une nécrose cellulaire, la disparition des cellules ciliées et des cellules caliciformes ; une augmentation de l'activité mitotique est observée dans les zones les plus atteintes.
Dans l'épithélium bronchique, les effets sont plus légers et le signe de destruction cellulaire le plus important est la disparition des cellules ciliées. Dans la région bronchique intrapulmonaire, on observe une modification de la fonction ciliaire et du flux mucociliaire bien que les cellules ciliées soient d'aspect normal.
À très fortes concentrations, la capacité d'absorption peut être dépassée, ce qui aboutit à un œdème laryngotrachéal ou pulmonaire puis à la mort des animaux. Le dioxyde de soufre perturbe le rejet des bactéries et des particules inertes hors des poumons.
La toxicité pour les voies respiratoires est potentialisée par l'inhalation simultanée d'aérosols liquides ou solides, d'ozone ou d'oxydes d'azote.
Irritation, sensibilisation [19]
Le dioxyde de soufre est corrosif pour les yeux et la peau. En raison de sa solubilité dans l’eau, il pénètre par la cornée dans l'humeur aqueuse où il s'hydrolyse provoquant une kératite profonde et une inflammation de l'iris. Le contact avec la peau entraîne des irritations et des brûlures caustiques. Ces effets sont dus à la formation d'acide sulfureux au contact des surfaces humides.
Le dioxyde de soufre potentialise l'effet sensibilisant de l'ovalbumine chez le cobaye : une exposition à une concentration faible (0,11 ppm, 8 h/j, 5 jours) entraîne une hypersensibilité, mise en évidence par une obstruction bronchique et des concentrations accrues d'anticorps spécifiques dans le sérum et le liquide de lavage bronchoalvéolaire[29].
Toxicité subchronique, chronique [19]
L'inhalation répétée provoque une atteinte bronchique chronique ; en cas d'ingestion, une altération de l'état général des animaux est notée avec une atteinte organique diffuse.
Les symptômes observés après une exposition chronique par inhalation ressemblent à ceux de la bronchite chronique : l'examen anatomo-pathologique des animaux révèle des modifications de la couche muqueuse de la trachée (hypertrophie des cellules caliciformes) et des glandes muqueuses. L'hypersécrétion de mucus et sa clairance réduite provoquent son accumulation le long du tractus respiratoire et une obstruction des voies aériennes. La dose sans effet observé sur la morphologie du tractus respiratoire est de 5 ppm chez le cobaye pendant 52 semaines, chez le singe pendant 78 semaines et chez le chien pendant 89 semaines. La concentration létale dépend de la concentration, de la durée d'exposition et de l'espèce ; la CL50 est de 150 ppm/35 jours chez la souris et de 130 ppm/24 jours chez le cobaye [26, 30].
Les ratios de sulfhémoglobine, de méthémoglobine, et la péroxydation lipidique augmentent chez des rats exposés à 10 ppm pendant 45 jours ; de même, des augmentations significatives du nombre de globules rouges et blancs, de l’hématocrite et de l’hémoglobine sont observées (1 h/j), [31]. Une augmentation de la peroxydation lipidique des érythrocytes est aussi rapportée chez des cobayes exposés à 10 ppm pendant 30 jours [32].
Au niveau hépatique, une augmentation de la taille des hépatocytes, associée à une vacuolisation cytoplasmique, est observée chez des cobayes exposés à 5,7 ppm de SO2 (22 h/j, 7 j/7, 52 semaines)[19] et chez des rats exposés à 15 ppm de SO2 (4 h/j, 8 semaines) [33].
Le bisulfite (de sodium ou de potassium) dans la nourriture du rat, de la souris, du cobaye et du singe, n'induit pas de toxicité jusqu'à la dose de 72 mg/kg/j ; au-delà de cette dose ingérée, peuvent survenir un arrêt de la croissance, une perte de poids, une atrophie viscérale, osseuse et médullaire, une inflammation de l'estomac, une polynévrite et un œdème testiculaire [21, 26].
Effets génotoxiques [26, 21, 34]
Les dérivés hydratés (acide sulfureux ou sulfites) peuvent produire des effets mutagènes et génotoxiques in vitro. Les tests in vivo sont négatifs.
In vitro
Tous les tests de mutagenèse étant réalisés en milieu aqueux, les résultats obtenus concernent l'effet du dioxyde de soufre hydraté (acide sulfureux ou sulfites). Il est mutagène pour certaines souches de E. coli et de S. typhimurium, les levures et les plantes. Dans les cellules de hamster en culture, le bisulfite induit une transformation morphologique et des échanges entre chromatides sœurs mais ni mutation, ni aberration chromosomique, ni réparation de l'ADN.
Une seule étude fait état d'augmentation du taux d'aberrations chromosomiques et d'échanges entre chromatides sœurs dans les lymphocytes humains en culture (sans activation métabolique), mais à des niveaux comparables aux témoins négatifs [35].
In vivo
Une augmentation significative de l'incidence des aberrations chromosomiques a été observée dans les cellules de la moelle osseuse des souris exposées à 5-10,7 et 21,4 ppm de dioxyde de soufre (4h/j pendant 7 jours) [36].
Le test des comètes a été effectué sur des cellules de souris exposées par inhalation (0- 5-10,7-21,4 et 42,7 ppm, 6h/j pendant 7 jours). Une augmentation des dommages à l'ADN en fonction de la dose a été démontrée dans tous les types de cellules étudiées, soit les cellules du cerveau, des poumons, du foie, de la rate, des reins, des intestins, des testicules, ainsi que dans les lymphocytes [37].
Il faut noter toutefois que ces études présentent des déficiences méthodologiques (comme l’absence de témoins historiques et de témoins positifs ou un faible nombre de cellules comptées) qui limitent l’interprétation des résultats obtenus [38].
Une étude réalisée selon les lignes directrices de l’OCDE ne met en évidence aucune augmentation du nombre de micronoyaux chez des souris exposées à 0-1-3-10 ou 30,5 ppm de SO2 (4 h/j pendant 7 jours) [39].
Effets cancérogènes [21]
Le dioxyde de soufre n’est pas cancérogène mais pourrait augmenter les effets cancérogènes d’autres substances, comme les hydrocarbures aromatiques polycycliques (effet co-cancérogène).
L'effet cancérogène du dioxyde de soufre n'a été testé par inhalation que dans une expérience chez la souris LX. Une augmentation significative de l'incidence des tumeurs pulmonaires a été observée chez les femelles (538 ppm de pureté non spécifiée, 5 min/j, 5 j/sem, pendant toute la durée de vie) ; elle serait la conséquence d'une réaction inflammatoire au dioxyde de soufre suivie d'un état de tolérance apparent qui accélérerait, chez ces animaux, la tendance naturelle à développer des tumeurs spontanées. En considérant les limitations méthodologiques de cette étude (1 seule dose, faible nombre d’animaux testés), les auteurs pensent que ces résultats ne justifient pas le classement cancérogène du dioxyde de soufre [40].
La possibilité d'un effet cocancérogène avec le benzo[a]pyrène a été étudiée chez le rat. Une augmentation du taux de tumeurs pulmonaires est mesurée chez les rats exposés, toute la durée de la vie, à du SO2 (10 ppm, 6 h/j) suivis de SO2 (4 ppm) + benzo[a]pyrène (10 mg/m3, 1 h/j).
Le dioxyde de soufre pourrait affecter la détoxication des xénobiotiques en inhibant, via la formation de glutathion réduit, sa conjugaison enzymatique avec les réactifs électrophiles. La conjugaison avec le glutathion étant la voie principale d'élimination des époxydes du benzo[a]pyrène dans le poumon, l'inhibition de cette voie pourrait expliquer l'effet cocancérogène du dioxyde de soufre avec les hydrocarbures aromatiques polycycliques [41].
Par ailleurs, chez le rat, le dioxyde de soufre pourrait activer l’expression de proto-oncogènes et inhiber l’expression de gènes suppresseurs de tumeurs, mécanismes moléculaires pouvant être en lien avec ses propriétés cocancérogènes [42].
Le dioxyde de soufre ne peut pas être classé pour sa cancérogénicité chez l’homme (CIRC groupe 3).
Effets sur la reproduction [19]
Les données sur la fertilité ne sont pas suffisantes pour conclure. Un effet foetotoxique est noté chez la souris.
Fertilité
Des rates exposées au dioxyde de soufre (2 ppm, 12 h/j, 3 mois) présentent un allongement du cycle ; celui-ci revient à la normale 7 mois après l'exposition. Chez les femelles présentant un cycle normal, une diminution de la taille des portées a été détectée [21].
Au cours d’une étude 2 générations menée chez la souris (0-5-12 ou 30 ppm, 9 jours avant la gestation et jusqu’au 12e-14e jour de gestation), aucun effet sur les performances reproductrices n’a été observé [43]. Aucun effet n’a été rapporté chez la souris (27 ppm, GD6 à GD16, 7 h/j) ou le lapin (75 ppm, GD6 à GD18, 7 h/J) [19].
Des études récentes ont toutefois mis en évidence des effets sur le système reproducteur masculin, chez la souris et le rat. Chez des souris exposées à 1,9 ppm de SO2 (6 h/j pendant 60 jours), une diminution significative du nombre de spermatozoïdes et une hausse de leurs malformations sont mesurées ; au niveau testiculaire, une atrophie de l’épithélium séminifère, une augmentation des espaces intertubulaires et une légère désorganisation des cellules germinales sont observées [44]. Une baisse de la qualité des spermatozoïdes ainsi qu’une altération de la morphologie et de l’ultrastructure de la barrière hémato-testiculaire ont aussi été rapportées chez des souris exposées à 10 ppm pendant 8 semaines (3 h/j) [45].
Chez le rat, une diminution de la motilité spermatique, une augmentation du poids des testicules, des dommages structuraux au niveau des tubes séminifères et une désorganisation des cellules germinales ont été observées (10 ppm, 4 h/j pendant 2 semaines) [46].
Développement
Des concentrations atmosphériques de 32 ou 65 ppm de dioxyde de soufre du 7e au 18e jour de gestation n'induisent pas, chez la souris, de toxicité maternelle ni de modification significative du nombre moyen de nouveau-nés vivants par portée ; en revanche, elles ont un effet sur le développement : baisse de poids à la naissance et augmentation du délai d'apparition de différents réflexes (redressement à J1 et rotation à J10). L'effet du dioxyde de soufre sur le développement des réflexes pourrait être symptomatique d'une altération de la coordination neuromusculaire [47].
Les fœtus de lapines exposées à 70 ppm du 6e au 18e jour de la gestation (7 h/j) présentent quelques variations mineures d'ossification : augmentation du nombre de variations squelettiques comme sections non ossifiées des os frontaux, fusion des os occipital et pariétal ou cotes supplémentaires. Chez la souris, une diminution du poids fœtal et un retard d’ossification au niveau des sternèbres et de l’os occipital sont rapportés (25 ppm, 7 h/j, du 6e au 15e jour de gestation). A part une diminution de la nourriture, aucune toxicité maternelle n’est présente [19].
Toxicité sur l’HommeL'exposition aiguë est responsable de troubles respiratoires sévères avec œdème pulmonaire et bronchoconstriction. Une hyperréactivité bronchique non spécifique peut persister longtemps après une exposition aiguë. Les expositions chroniques sont caractérisées par des bronchites et pharyngites chroniques. L'exposition à ce gaz peut également exacerber des affections respiratoires préexistantes. Les données actuelles ne permettent pas de considérer le dioxyde de soufre comme un cancérogène direct chez l'Homme.
Le dioxyde de soufre est un gaz en partie responsable de la pollution atmosphérique des grandes agglomérations industrielles.
Toxicité aiguë [1]
L'inhalation est la principale voie d'exposition. Lors d'un dégagement accidentel, l'exposition massive peut provoquer soit une bronchiolite oblitérante ou un œdème pulmonaire hémorragique rapidement mortel soit une atteinte respiratoire obstructive sévère partiellement réversible, rebelle aux thérapeutiques, soit rester asymptomatique avec ou sans anomalie aux épreuves fonctionnelles respiratoires. Il est donc nécessaire de contrôler la fonction pulmonaire en cas d'intoxication accidentelle au SO2 [48, 49].
Au décours d'une intoxication aiguë, on peut voir se développer un syndrome obstructif ou un état d'hyperréactivité bronchique qui peut persister pendant plusieurs années. Une exposition à des doses inférieures à 50 ppm provoque une irritation des muqueuses : rhinite, laryngite, bronchite et conjonctivite [50].
Les expérimentations humaines réalisées chez des sujets normaux ou asthmatiques ont permis de mettre en évidence qu'une inhalation de courte durée au SO2 à une concentration de 5 à 10 ppm peut produire une bronchoconstriction probablement réflexe chez les adultes sains. Les sujets souffrant d'affection respiratoire, asthme notamment, présentent une plus grande sensibilité aux expositions même modérées au SO2 [51 à 53]. Chez l'asthmatique, l'effet bronchoconstricteur du SO2 est augmenté par l'effort physique pour des concentrations faibles de 0,1 ppm.
Les autres effets sont liés à la transformation du SO2 en acide au contact de l'eau. On peut observer une forte irritation cutanée et, en cas de contact oculaire, les vapeurs peuvent causer une conjonctivite et le liquide des brûlures cornéennes avec perte de la vue par opacification cornéenne. Le contact avec les muqueuses digestives peut provoquer des brûlures de la cavité buccale, de l'œsophage et de l'estomac.
Toxicité chronique [1, 54, 50, 55]
L'exposition prolongée (pollution atmosphérique, exposition professionnelle) augmente l'incidence de pharyngite et de bronchite chronique. Celle-ci peut s'accompagner d'emphysème et d'une altération de la fonction pulmonaire en cas d'exposition importante et prolongée. Les effets pulmonaires sont augmentés par la présence de particules respirables, le tabagisme et l'effort physique. L'inhalation peut aggraver un asthme préexistant et les maladies pulmonaires inflammatoires ou fibrosantes.
De nombreuses études épidémiologiques ont démontré que l'exposition au dioxyde de soufre, à des concentrations normalement présentes dans l'industrie ou dans certaines agglomérations, peut engendrer ou exacerber des affections respiratoires (toux chronique, dyspnée) [54] et entraîner une augmentation du taux de mortalité par maladie respiratoire ou cardiovasculaire (maladie ischémique) [54, 50].
Effets cancérogènes [1, 21, 54]
On a suggéré que le dioxyde de soufre pouvait jouer un rôle cocancérogène dans le développement de cancer broncho-pulmonaire. Une étude suédoise suggère aussi qu'il pourrait être génotoxique (augmentation de la prévalence d'anomalies chromosomiques chez des ouvriers produisant de la pulpe de bois). Cependant, aucune donnée épidémiologique ne permet de le considérer comme directement cancérogène [54]. Le CIRC estime que les données existantes ne permettent pas de classer le dioxyde de soufre du point de vue de sa cancérogénicité pour l'homme (groupe 3) [21].
Cohérence des réponses biologiques chez l'Homme et l'animal
