Pathologie - Toxicologie
-
Toxicocinétique - Métabolisme [1, 5]
Le DEHP est rapidement absorbé chez l’homme et l’animal par voie orale après hydrolyse en MEHP (phtalate de mono(2-éthylhexyle)). L’absorption par voie cutanée semble faible chez l’homme alors qu’elle a été mise en évidence par inhalation. Le MEHP est largement distribué dans les tissus sans qu’une accumulation soit observée puis il subit une série d’oxydations dans le foie, très poussées chez le rat et plus réduites chez les primates et l’homme. Chez ce dernier, les métabolites sont ensuite largement conjugués à l’acide glucuronique. L’excrétion intervient rapidement par voies urinaire et fécale avec une grande variabilité inter-espèce et inter-individuelle chez l’homme.
Chez l'animal
Absorption
De nombreuses études sur l'animal ont montré que le DEHP est rapidement absorbé par le tractus gastro-intestinal, principalement après hydrolyse en phtalate de mono(2-éthylhexyle) (MEHP) par des lipases. Le degré d'absorption chez le rat, les primates non humains ainsi que l'homme peut être évalué à environ 50 % pour des doses allant jusqu'à 200 mg/kg. L'absorption semble plus faible chez l'homme et les primates que chez le rat, probablement du fait d'une activité réduite des lipases. Un seuil d'hydrolyse du DEHP en MEHP induisant une proportion plus importante de DEHP intact au contact des tissus a été mis en évidence chez le rat.
L'absorption pulmonaire du DEHP a été montrée chez l'homme et le rat mais non quantifiée.
L'absorption cutanée chez les rongeurs est d'environ 20 % de la dose appliquée. Une étude in vitro a par ailleurs montré que l'absorption cutanée du DEHP était quatre fois plus importante chez le rat que chez l'homme.
Distribution
La totalité du DEHP sanguin est liée aux protéines avec une demi-vie de 18,6 heures ; son produit d'hydrolyse, le MEHP, s'équilibre entre les formes libre et liée de l'albumine avec une demi-vie plus élevée. La substance se dépose d'abord dans le tractus gastro-intestinal, le foie et les reins, puis dans les muscles, les poumons, les testicules et le cœur. Elle est rapidement éliminée de l'organisme : la majorité en 24 heures, le reste en 3 à 5 jours avec une rétention tissulaire faible. Aucune accumulation n'est observée après administration orale de 2,8 g/kg/j pendant 7 jours ou 5 g/kg dans la nourriture pendant 5-7 semaines. La clairance rapide et le faible potentiel d'accumulation tissulaire des diesters phtaliques sont la cause de leur faible toxicité aiguë et chronique.
Métabolisme
Le DEHP est transformé, avant absorption, en MEHP et 2-éthylhexanol (2-EH) par une hydrolase. Cette lipase, présente dans la majorité des organes, est particulièrement active dans le suc pancréatique et la muqueuse intestinale. Le métabolisme oxydatif du MEHP commence par une hydroxylation de la chaîne latérale éthylhexyle par le système des monooxygénases mixtes cytochrome P450 dépendantes ; cette activité existe au niveau hépatique chez le rat ; mais aussi au niveau rénal et pulmonaire chez le lapin. Si les voies métaboliques largement étudiées chez le rat et le lapin (fig. 1) sont probablement identiques chez les autres mammifères, elles diffèrent sur le plan quantitatif.
Ainsi chez le singe, l'hydrolyse est très faible et la ß-oxydation (responsable de la formation du métabolite impliqué dans les phénomènes de cancérogenèse hépatocellulaire) intervient à un degré moindre comparé au rat ou à la souris.
Le 2-éthylhexanol (2-EH) est rapidement métabolisé en acide 2-éthylhexanoïque (2-EHA) dans de nombreux tissus. Cet acide est soumis à des oxydations menant finalement à l'acétate et au dioxyde de carbone. La décomposition des intermédiaires de l'oxydation produit de faibles quantités de 2- et 4-heptanone.
A chaque étape du métabolisme, les produits peuvent être convertis en glucuro-conjugués ; le taux de glucuronides urinaires dérivés du MEHP est insignifiant chez le rat, modéré chez le hamster (15 %) et élevé chez la souris (64 %), les primates (80 %) et l'homme (80 %). La conjugaison permet généralement de diminuer la toxicité potentielle des substances. Le mécanisme de glucuro-conjugaison n'étant fonctionnel qu'à l'âge de trois mois chez les enfants, les fœtus et nouveaux-nés peuvent donc être particulièrement vulnérables à une exposition au DEHP.
Schéma métabolique
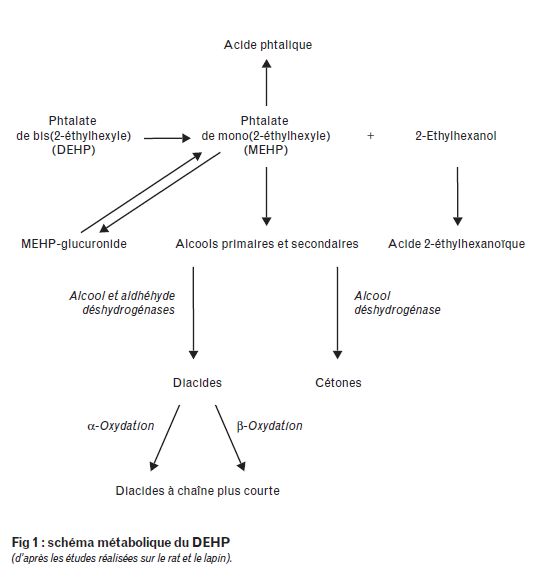
Excrétion
L'excrétion du DEHP et de ses métabolites est rapide : chez la souris et le rat, jusqu'à 60 % d'une dose orale ou intraveineuse apparaissent dans les urines en 24 heures, 1 à 15 % sont excrétés dans les 7 jours suivants ; le lapin excrète 65 % d'une dose orale dans l'urine alors que le chien excrète une grande majorité de la dose dans les féces (56-75 %). Si les métabolites urinaires du MEHP sont identiques dans toutes les espèces sur le plan qualitatif, la distribution quantitative varie avec l'espèce, l'âge de l'animal et la dose. La répartition de l'excrétion des métabolites, entre l'urine et les féces, est indépendante de la dose mais dépend fortement de l'espèce, du sexe, de la voie et du mode d'administration.
Toxicité expérimentaleToxicité aiguë [1, 5]
Le DEHP montre une toxicité aiguë relativement faible. Un effet sensibilisant respiratoire est suspecté, mais il n’est pas irritant pour la peau et les yeux.
Une étude de toxicité aiguë par inhalation chez le rat a permis de déterminer une CL50 supérieure à 10 g/m3/4h. Par exposition orale, la DL50 a été évaluée comme supérieure à 20 ou 40 g/kg chez le rat et supérieure à 10 ou 20 g/kg chez la souris, suivant les études. Une étude de toxicité cutanée chez le lapin conclut à une DL50 d'environ 25 ml/kg mais la fiabilité de l'étude peut être mise en doute. Néanmoins, l'absorption cutanée étant réduite, la toxicité aiguë cutanée attendue pour ce produit est faible.
Deux études d'exposition cutanée chez des lapins (DEHP pur, 4 h) ont montré une irritation nulle ou légère dans un des cas (faible érythème). Sur un essai exposant la peau de lapin à du DEHP pur pendant 24 heures avec ou sans abrasion préalable de la peau, des irritations faibles à modérées étaient observées 24 heures après l'application mais disparaissaient à 72 heures. Ces éléments permettent de supposer que l'irritation cutanée sera très faible chez l'homme, le lapin étant en général plus sensible que l'homme. Sur l'œil de lapin, l'application de 0,1 ml de DEHP pur ne provoque qu'une faible irritation passagère se manifestant par une rougeur de la conjonctive. L'iris et la cornée ne sont pas affectés. Aucune étude permettant d'évaluer l'irritation respiratoire n'a été réalisée.
Aucun effet de sensibilisation cutanée n'a été mis en évidence sur le cobaye par test de maximalisation et test de Buehler (à des concentrations de 40 à 100 % de DEHP). Une étude in vitro sur du tissu trachéal de rat a montré que l'exposition au DEHP n'avait pas d'effet mais qu'une exposition à 10-4 moles de MEHP induit une augmentation réversible du taux de méthacholine .
Toxicité subchronique, chronique [1, 5]
Les organes cibles identifiés sont le foie, les reins et les testicules. A moyen et long terme chez les rongeurs, la toxicité se manifeste sur le foie principalement par une prolifération des péroxysomes. Cette prolifération n’a pas été observée chez les primates et semble peu extrapolable à l’homme.
Chez le rat, l'exposition par voie orale à 25 mg/kg/j pendant 16 j n'induit pas d'effet toxique ; une dose de 400 mg/kg/j provoque une diminution du gain de poids corporel. Après une dose de 2 g/kg/j pendant 14 jours, l'examen anatomopathologique révèle une hépatomégalie accompagnée d'une induction de la prolifération des péroxysomes dans les deux sexes, une hypotriglycéridémie et une hypocholestérolémie uniquement chez les mâles et une atrophie testiculaire accompagnée d'une baisse des concentrations testiculaires en zinc. L'intensité de l'atrophie est fonction de la voie, de la dose et de la durée d'exposition et inversement proportionnelle à l'âge de l'animal. La dose sans effet pour l'appareil reproducteur du mâle est estimée à 4,8 mg/kg/j [7].
Par ailleurs, il semble que la variabilité de la toxicité entre les différentes espèces soit importante. Chez la souris, les mêmes effets que chez le rat sont observés avec une sensibilité moindre puisque la NOAEL a été estimée à 100 mg/kg/j dans une étude de toxicité chronique. Chez le singe, une étude à court terme sur le marmouset n'identifie pas d'effet sur le foie et les testicules et seulement une faible augmentation des péroxysomes alors qu'une étude comparable chez le rat mettait en évidence une prolifération des péroxysomes marquée. La même différence de sensibilité a été notée sur une étude à court terme sur le singe Cynomolgus et des études sur le marmouset à des doses allant jusqu'à 2500 mg/kg/j pendant 13 semaines n'ont montré aucun effet sur le foie, les reins et les testicules. Seules une faible diminution du gain de poids et une faible prolifération des péroxysomes ont été notées ainsi qu'une diminution du poids de la rate. Des études in vitro ont également confirmé une sensibilité plus grande des hépatocytes de rats aux métabolites du DEHP que ceux du cobaye, du lapin, du singe Cynomolgus et de l'homme.
De plus, des études récentes ont conclu que les effets hépato-toxiques chez les rongeurs font intervenir l'activation de récepteurs spécifiques (Peroxisome Proliferator-Activated Receptors ou PPAR) qui induisent la prolifération des péroxysomes. Dans le foie humain, il a été démontré que le récepteur PPAR-α est présent à un niveau plus faible que chez le rat et qu'il a également une activité plus faible ce qui permet de conclure que le mécanisme par lequel le DEHP induit des effets sur le foie chez les rongeurs est négligeable chez l'homme.
Enfin, l'administration prolongée par voie orale chez le rat (150 mg/kg, 3 fois/sem, 1 an) provoque des kystes rénaux.
Effets génotoxiques [1, 5]
Le DEHP n’est pas considéré comme génotoxique.
In vitro, la plupart des tests réalisés avec le DEHP sont négatifs ; seules l'induction d'aneuploïdie (sur levures et cellules hépatiques de hamster chinois) et la transformation cellulaire ont donné des résultats positifs. Le MEHP (25-50 µg/ml) est clastogène pour les cellules embryonnaires de hamster syrien (en présence d'activateur métabolique de foie de rat) et les lignées cellulaires CH0 et RL4.
In vivo, les test effectués avec le DEHP et MEHP (aberrations chromosomiques et micronoyaux sur moelle osseuse, synthèse non programmée de l'ADN dans les cellules hépatiques, mutation létale dominante) sont négatifs. L'urine de rat exposé au DEHP donne des résultats négatifs dans le test d'Ames. Enfin, l'induction d'une aneuploïdie in vitro mais pas in vivo pourrait être due aux propriétés détergentes de la substance.
Effets cancérogènes [1, 5]
Le DEHP est un cancérogène hépatique chez le rat et la souris. Les récepteurs PPAR qui sont à l’origine de la prolifération des péroxysomes et des hépatocytes ont un rôle central dans la médiation des effets hépato-toxiques. Chez l’homme, les PPAR sont peu présents et peu actifs et le DEHP n’est pas considéré comme cancérogène.
Le DEHP administré à forte dose pendant 2 ans dans la nourriture du rat (0,6 à 1,2 %) et de la souris (0,3 à 0,6 %) est un cancérogène hépatique pour ces deux espèces : augmentation du taux d'adénomes et de carcinomes hépatocellulaires, avec métastases pulmonaires chez la souris. Aucun effet cancérogène n'a été montré chez le hamster (par injection intrapéritonéale de 3 g/kg, 1 fois/sem, 18 sem ou par inhalation de 15 µg/m3 pendant toute la durée de vie).
Chez la souris, il se comporterait comme promoteur tumoral hépatique (adénomes après initiation par une injection intrapéritonéale de diéthylnitrosamine) et cutané (papillomes chez la souris SENCAR après initiation par le diméthylbenzanthracène). Les résultats des essais de génotoxicité semblent montrer qu'il n'agit pas comme initiateur.
La formation de tumeurs dans le foie s'explique en grande partie par l'induction par le DEHP de la prolifération des péroxysomes qui engendre une augmentation de la production de peroxyde d'hydrogène. L'augmentation consécutive du stress oxydatif semble impliquée directement et indirectement dans des altérations de l'ADN et des transformations néoplasiques. La prolifération hépatocytaire semble également mise en cause dans le développement de tumeurs. Il a été démontré que l'activation de la prolifération des péroxysomes ainsi que des hépatocytes se fait par l'intermédiaire de récepteurs nucléaires ou PPAR qui ont donc un rôle central dans la cancérogénicité hépatique du DEHP. Une grande variabilité de sensibilité hépatique interespèces est observée, s'expliquant par des niveaux d'expression et d'activité des PPAR variables. En effet, les études de toxicités chroniques/subchroniques et in vitro (cf. ci-dessus) ont montré une sensibilité hépatique élevée chez le rat et la souris, intermédiaire chez le hamster et moindre chez les primates et l'homme qui semble donc relativement protégé des effets cancérogènes du DEHP. Cet élément est également confirmé par l'absence d'anomalie induite chez des patients traités par des agents hypo-lipidémiants (eux-mêmes proliférateurs de péroxysomes et inducteurs de cancers chez le rat).
Effets sur la reproduction [1, 6]
Les testicules sont un organe cible du DEHP et des atteintes sévères du système reproducteur mâle ont été clairement mises en évidence chez les rongeurs par voie orale. L’effet du DEHP et de ses métabolites est particulièrement sensible sur les animaux jeunes ainsi que par exposition prénatale durant la gestation et par le lait maternel. Le DEHP altèrerait également la fertilité chez la femelle. Par ailleurs, une exposition orale au DEHP induit chez les rongeurs une mortalité fœtale accrûe, des malformations et des retards de croissance dans la descendance. Ces éléments ont amené la classification du DEHP par l’UE comme substance devant être assimilée à une substance causant des effets toxiques sur la fertilité et le développement dans l’espèce humaine (toxique pour la fertilité et le développement de catégorie 2).
Fertilité
Le DEHP a été identifié dans de nombreuses études par voie orale chez les rongeurs comme provoquant une atteinte sévère du système reproducteur mâle et de façon moins documentée de la fertilité chez la femelle. Ces effets semblent principalement attribués à son métabolite principal, le MEHP.
Les effets sur le système reproducteur mâle se manifestent par ordre de sévérité par une atrophie testiculaire et épididymaire, une diminution de la concentration testiculaire en zinc, une altération de la qualité du sperme ainsi qu'une atrophie des tubes séminifères allant jusqu'à la perte complète de la spermatogenèse. Une augmentation progressive de la vacuolisation des cellules de Sertoli a été observée à partir de doses très faibles et est considérée par certains auteurs comme un signe précoce d'atteinte testiculaire. Ces cellules sont le site d'action de l'hormone FSH, responsable de l'initiation de la spermatogenèse. Son rôle est particulièrement important à la puberté, période durant laquelle une sensibilité accrûe des jeunes rats au DEHP a été mise en évidence. Des études in vitro confirment que l'altération de la fonction reproductrice mâle semble intervenir par l'action du DEHP ou de ses métabolites sur les cellules de Sertoli. D'autres études ont également émis l'hypothèse d'une action sur les cellules de Leydig.
Les effets constatés ne semblent pas faire intervenir la prolifération des péroxysomes et sont donc considérés comme extrapolables à l'homme. Néanmoins, des différences de sensibilité ont été constatées entre les espèces avec une sensibilité marquée chez le rat, la souris et le furet, moindre chez le hamster et nulle chez le marmouset exposé à de fortes doses (2500 mg/kg/j) pendant 13 semaines et chez le singe Cynomolgus pré-pubère. Ces différences peuvent s'expliquer en partie par une hydrolyse moindre du DEHP en MEHP en raison d'un taux plus faible de lipase intestinale chez les primates que chez les rongeurs. Cependant, l'évaluation de risque européenne [1] a choisi de retenir une NOAEL pour la fertilité de 4,8 mg/kg/j, déterminée dans une étude de toxicité sur la reproduction sur 3 générations chez le rat exposé par voie orale [7].
Chez le rat et la souris, un traitement oral par du DEHP semble également produire des effets sur la fonction reproductrice femelle se manifestant notamment par des défauts d'ovulation et une altération du cycle oestral.
Développement
Les nombreuses études par voie orale chez les rongeurs qui visent à évaluer la toxicité sur le développement du DEHP ainsi que de ses métabolites le MEHP, le 2-EH, le 2-EHA et l'acide phtalique montrent de façon cohérente que le DEHP provoque des malformations ainsi qu'une mortalité intra-utérine et des retards de développement qui ne sont pas fortement associés à une toxicité maternelle. Les principales malformations observées portent sur le squelette axial, le squelette appendiculaire, le système cardiovasculaire, les yeux et le tube neural. Le panel d'experts du NTP-CERHR [5] et l'évaluation de risque européenne [1] concluent de façon concordante à une NOAEL pour les malformations de 40 mg/kg/j. Le MEHP a également été identifié comme tératogène et toxique pour le développement ainsi que le 2-EH et le 2-EHA comme toxiques pour le développement. Le 2-EHA est par ailleurs un isomère de structure de l'acide valproïque, tératogène connu pour l'homme et l'animal et semble agir par l'induction d'une déficience en zinc.
Chez le rat, des dommages irréversibles sur le système reproducteur mâle ont été observés à des doses de DEHP ingérées n'induisant pas de toxicité maternelle par exposition des fœtus in utero ainsi que par exposition de jeunes rats pendant la période d'allaitement à des niveaux de doses très bas [7]. L'observation dans la descendance mâle d'une diminution de la distance ano-génitale, d'hypospadias, de la non régression des mamelons ainsi que d'un retard dans la descente des testicules et la séparation du prépuce indique également un vraisemblable effet de perturbateur endocrinien anti-androgène. Ceci a été confirmé par la mise en évidence in vitro de la capacité du MEHP à se fixer au récepteur humain aux œstrogènes.
Toxicité sur l’Homme [1, 5]Les données sur la toxicité humaine du DEHP sont rares et portent sur des effectifs réduits. La toxicité aiguë ne semble pas préoccupante et seul un faible pouvoir sensibilisant sur les voies respiratoires est suspecté. Certains éléments indiquent une possible activité de perturbateur endocrinien. Aucune donnée humaine sur les effets cancérogènes n’est disponible.
Toxicité aiguë
Une étude de cas portant sur 2 hommes rapporte que l'ingestion d'une dose de 5 g n'a fait apparaître aucun symptôme alors qu'une dose de 10 g a provoqué des troubles gastriques modérés.
L'exposition cutanée au DEHP pur pendant 7 jours chez 23 personnes montre que le DEHP n'est pas un irritant cutané. Aucune donnée sur l'homme n'est disponible en ce qui concerne l'irritation oculaire et respiratoire.
Alors que le DEHP ne semble pas avoir d'effet de sensibilisation cutanée, quelques études ont suggéré qu'il peut favoriser le développement d'obstruction bronchique et d'asthme mais le lien entre le DEHP et les effets décrits n'est pas clairement établi[1].
Toxicité chronique [8, 9]
Trois enquêtes épidémiologiques chez des travailleurs exposés à divers phtalates, dont le DEHP, et à des alcools ont montré une forte incidence de neuropathie centrale (narcose), périphérique (polynévrite sensitivomotrice) ou autonome (hypertension artérielle, hyperhydrose palmoplantaire). L'examen sanguin a retrouvé une légère pancytopénie avec réticulocytose modérée et accélération de la vitesse de sédimentation. Cependant, en raison de l'exposition multiple, il est difficile d'évaluer la toxicité propre au DEHP à partir de ces observations.
Un étude réalisée dans une usine de production de film en polychlorure de vinyle où le DEHP était le principal plastifiant utilisé ne retrouve pas d'anomalies de la fonction respiratoire ; quelques perturbations mineures de certains indices biologiques (légère anémie, augmentation des IgA) sont observées, qui demandent à être confirmées.
Aucune étude relatant une toxicité rénale ou concernant les effets sur la reproduction chez l'homme n'a été publiée.
Effets génotoxiques
Chez 10 ouvriers d'une usine produisant du DEHP dont l'exposition était comprise entre 0,01 à 0,16 mg/m3 pendant 10 à 30 ans, aucune augmentation de la fréquence des aberrations chromosomiques n'a été observée par rapport au groupe témoin [10] ce qui semble confirmer le caractère non-génotoxique du DEHP mais les résultats de cette étude sont difficilement interprétables du fait du nombre limité de sujets observés.
Effets cancérogènes [9, 11]
Une étude épidémiologique réalisée en Italie a mis en évidence un excès de cancer du poumon chez des sujets exposés à divers phtalates, dont le DEHP, et à l'acétylène. Cependant, les données disponibles chez l'homme ne permettent pas une évaluation satisfaisante du risque cancérogène du DEHP.
Effets sur la reproduction
Des niveaux élevés et significatifs de phtalates, dont le DEHP, et de son métabolite le MEHP ont été relevés dans 68 % des échantillons de sérum sanguin de fillettes de moins de 8 ans présentant un développement des seins prématuré [12]. Les auteurs de cette étude suggèrent une activité de perturbateur endocrinien sans qu'un lien direct puisse pas établi.
Cohérence des réponses biologiques chez l'Homme et l'animal
