Pathologie - Toxicologie
-
Toxicocinétique - Métabolisme [6, 7]
Chez l’animal comme chez l’homme, l’acrylamide est bien absorbé quelles que soient les voies d’exposition ; il se distribue dans tout l’organisme et ses métabolites sont éliminés principalement dans l’urine. Il forme des adduits à l’hémoglobine et à l’ADN.Il passe la barrière placentaire et est excreté dans le lait maternel.
Chez l'animal
Absorption
L’acrylamide est rapidement et fortement absorbé par voie orale et, à taux moindre, par voie cutanée. Par voie orale, les pourcentages d’absorption varient en fonction de l’espèce et du mode d’administration. Ainsi, par gavage, 32 à 52 % de la dose administrée sont absorbés chez la souris alors que 60 à 98 % de la même dose sont absorbés chez le rat. Lorsque que l’acrylamide est mélangé à de la nourriture, ces pourcentages se réduisent à 23 % chez la souris et 28 à 47 % chez le rat [8, 9].
Par voie cutanée, 20 à 30 % de la dose appliquée sont absorbés en 24 heures chez le rat [10, 11].
Distribution
Une fois absorbé, l’acrylamide est rapidement distribué par le sang dans tout l’organisme et traverse la barrière placentaire [12].
Métabolisme
Les voies métaboliques de l’acrylamide sont qualitativement semblables chez l’homme et chez l’animal mais des différences quantitatives existent (cf. figure 1).
La voie majeure est une conjugaison avec le glutathion catalysée par la glutathion-S-transférase (GST) hépatique menant à la formation de deux métabolites principaux : N-acétyl-S-(2-carbamoyléthyl)cystéine (AAMA) et N-acétyl-S-(2-carbamoyl-2-hydroxyéthyl)cystéine (GAMA) chez le rat et la souris. Le rapport des métabolites urinaires GAMA/ AAMA est de 0,2 chez le rat et 0,5 chez la souris [12].
La formation de glycidamide, métabolite génotoxique, par l’intermédiaire du cytochrome CYP2E1, est une voie secondaire saturable (51 % des molécules à 5 mg/kg et 13 % à 100 mg/kg) [13]. Elle est plus importante chez la souris que chez le rat.
L’acrylamide et le glycidamide forment des adduits avec la cystéine (au niveau des groupements sulfhydryles) et la valine (au niveau de la terminaison aminée) de l’hémoglobine ; ces adduits persistent dans les érythrocytes avec une demi-vie estimée à 10,5 jours. Chez la souris, les adduits avec le glycidamide sont plus nombreux que chez le rat, quelle que soit la dose ou la voie d’exposition (reflet d’une oxydation de l’acrylamide plus importante chez la souris).
In vivo, la formation d’adduits acrylamide-ADN n’a pas été décelée : elle a seulement été observée in vitro. Le glycidamide étant beaucoup plus réactif que l’acrylamide, des adduits glycidamide-ADN ont été mis en évidence in vitro et in vivo, chez le rat et la souris exposés à de l’acrylamide dans tous les organes [6]. La demi-vie des adduits à l’ADN, variable selon les adduits et les tissus considérés, est comprise entre 19 et 89 heures [12].
Schéma métabolique
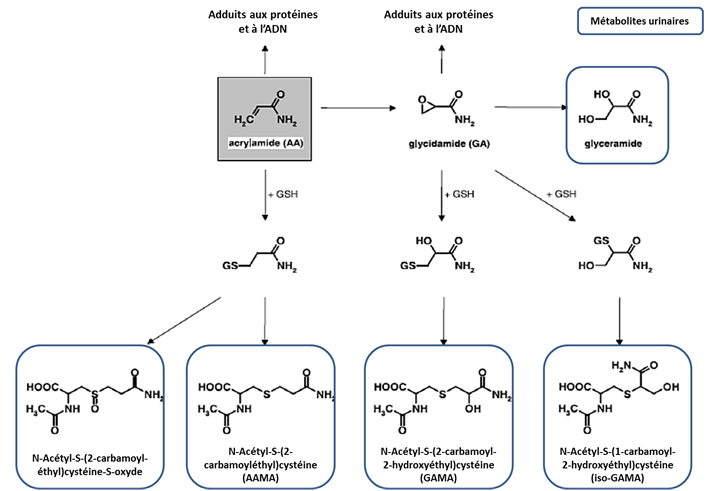
Figure 1 : Principales voies métaboliques de l'acrylamide [14, 18].
Excrétion
La substance est transformée dans sa quasi-totalité chez le rat. Moins de 2 % de la dose sont éliminés inchangés dans la bile ou l’urine. L’acrylamide et ses métabolites subissent un cycle entéro-hépatique (15 % passent dans la bile et seulement 6 % dans les fèces). Après exposition par voies orale, cutanée ou inhalatoire, 40 à 90 % des molécules radiomarquées sont éliminées en une semaine dans l'urine, 4 à 6 % dans l'air expiré sous forme de CO2 et 6 % dans les fèces.
L'acrylamide traverse la barrière placentaire, les concentrations sanguines des fœtus sont corrélées à celles des mères ; des adduits acrylamide-hémoglobine ont été mesurés dans le cordon ombilical de nouveau-nés. Une excrétion d'acrylamide et de ses métabolites a également été montrée dans le lait maternel.
Chez l'Homme
- Absorption [14]: L'acrylamide est rapidement absorbé par voies orale, inhalatoire et cutanée. L'absorption orale (une dose en solution aqueuse, 0,5 - 1 ou 3 mg/kg) et cutanée (3 mg/kg, une fois par jour pendant 3 jours) a été mesurée, avec des molécules radiomarquées, chez des volontaires hommes [15, 16]. L'absorption par voie digestive est rapide et importante (40 % de la dose ingérée) ; des signes d'intoxication aiguë sont apparus dans les 3 heures après l'ingestion volontaire d'acrylamide, témoignant d'une absorption rapide du produit par cette voie. Par voie cutanée, entre 30 et 35 % de la dose administrée seraient absorbés. Aucune donnée quantitative n’est disponible par inhalation.
- Distribution : Une fois absorbé, l’acrylamide est rapidement distribué par le sang dans tout l’organisme.
- Métabolisme : Comme chez l’animal, deux voies de métabolisation ont été identifiées. La principale correspond à la conjugaison avec le glutathion, à l’origine de la formation de cystéine-S-propionamide, avant une élimination sous forme d’acide mercapturique (AAMA) ou de son sulfoxyde. La seconde voie de métabolisation est la voie oxydative et conduit à la formation de glycidamide, un époxyde très réactif, à son tour réduit en glycéramide ou conjugué avec le glutathion en 2 isomères (GAMA et iso-GAMA). Après exposition orale, une relation dose-réponse peut être établie entre l’exposition et la formation d'adduits à l'hémoglobine (N- (2-carbamoyléthyl)valine (AAVal) et N-(2-carbamoyl-2- hydroxyéthyl)valine (GAVal)) ; après exposition cutanée, les deux adduits sont mesurés en quantité moindre. Les deux adduits sont formés en quantités identiques et sont stables dans le temps. De nombreux autres adduits à l’hémoglobine ont été identifiés chez l’homme [12]. Une relation dose-effet est retrouvée entre les taux d'adduits à l'hémoglobine formés et les effets neurologiques périphériques. En dessous d'un taux d'adduits à l'hémoglobine de 0,3 nmol/g d'hémoglobine, aucun signe neurologique n'est observé [17]. Aucun adduit à l’ADN n’a été mis en évidence chez l’homme jusqu’à ce jour [12].
- Excrétion : Des quantités faibles d’acrylamide sont mesurées dans les urines. A la suite d’une exposition par voie orale, l’acrylamide urinaire représenterait 8,5 à 10 % de la dose initiale ; ce pourcentage serait seulement de 4 % après une exposition cutanée [16]. La demi-vie d’élimination urinaire de l’acrylamide a été estimée entre 3 et 4 heures[15]. L'excrétion urinaire des 2 métabolites majeurs en 24 heures correspond à 30-45 % de la dose orale ingérée (le pourcentage atteint 50 % après 72 heures), et à 1 % de la dose cutanée appliquée (le pourcentage atteint 3,2 % après 72 heures). Le rapport des métabolites urinaires GAMA/ AAMA est compris entre 0,02 et 0,16, se rapprochant de celui du rat. Concernant le sulfoxyde d’AAMA urinaire éliminé en 24 heures, il représente 7 à 9 % de la dose ingérée et seulement 0,1 % de la dose appliquée. En ce qui concerne les autres métabolites identifiés (glycidamide, GAMA et iso-GAMA), suite à une exposition par voie orale ou cutanée, les quantités éliminées dans les urines en 24 heures sont inférieures à 3 %.
Surveillance Biologique de l'exposition [18-25]
Etant donné la bonne pénétration cutanée de l’acrylamide, la mise en place d’une surveillance biologique est intéressante.
Les dosages sanguins des adduits à l’hémoglobine du glycidamide et de l’acrylamide (GAVal et AAVal) sont proposés pour la surveillance biologique (SBE) des sujets professionnellement exposés ; ils reflètent l’exposition des trois derniers mois. Certaines études ont montré une corrélation avec l’exposition et une relation dose effet entre les taux d'adduits à l'hémoglobine formés et les effets neurologiques périphériques. La Commission allemande (DFG) recommande le dosage des adduits AAVal avec un taux de 400 (et 200) pmol/g Hb, pour une exposition à l’acrylamide de 0,07 mg/m3 (0,035 mg/m3) (valeur EKA Expositionsäquivalente für krebserzeugende Arbeitsstoffe) ; elle a fixé une valeur BLW (Biologischer Leit-Wert) sur la base d’effets neurologiques (neuropathie périphérique) pour les adduits AAVal à 550 pmol/g Hb. Pour la population générale non professionnellement exposée, des taux non nuls d’adduits AAVal sont retrouvés, liés probablement au tabagisme ; la DFG a fixé une valeur BAR (Biologischer Arbeitsstoff Referenzwerte) à 50 pmol/g Hb pour les adduits AAVal. Par contre il n’existe que très peu de données sur le GAVal.
Les dosages des acides mercapturiques urinaires, N-acétyl-S-(2-carbamoyléthyl)cystéine (AAMA) et N-acétyl-S-2-(2-carbamoyl-2-hydroxy-éthyl)cystéine (GAMA) - métabolites majeurs, en fin de poste et fin de travail sont proposés pour la SBE. Ils reflèteraient l’exposition des derniers jours. Chez des salariés de la production d’acrylamide, 90% des résultats de AAMA urinaires de fin de poste sont inférieurs à 540 µmol/mol créatinine (soit 1100 µg/g créatinine), ce qui correspondrait à une exposition de l’ordre de 0,07 mg/m3. De plus, les concentrations urinaires d’AAMA et de GAMA sont influencées par de nombreux facteurs individuels (alimentation, tabac, etc.). La DFG a fixé pour la population générale non professionnellement exposée une valeur BAR à 100 µg/g. créatinine pour l’AAMA urinaire.
Le dosage d’un autre acide mercapturique, le S-carboxyéthyl-cystéine (CEC) urinaire en fin de poste de travail a pu être proposé; ce paramètre n’est pas spécifique (métabolite commun à l’acrylonitrile et aux acrylatex) et des taux de CEC urinaires non négligeables sont retrouvés chez les fumeurs non professionnellement exposés, à des concentrations voisines de celles observées chez des sujets exposés à la VLEP/10.
Le comité d'experts spécialisés (CES) VLEP de l’Anses recommande les adduits à l’hémoglobine de l’acrylamide dans le sang (AAVal) comme IBE pertinent (indice biologique d'exposition), sans valeur limite biologique chiffrée associée et deux VBR (valeur biologique de reference) pour les adduits AAVal à partir des données de population générale en fonction du statut tabagique : 285 pmol/g Hb pour les fumeurs et 85 pmol/g Hb chez les non-fumeurs.
Toxicité expérimentaleToxicité aiguë [6]
En exposition aiguë, l’acrylamide est toxique pour l’animal ; il provoque une atteinte des systèmes nerveux central et périphérique. Il est irritant pour l’œil et la peau, et sensibilisant cutané.
Pour toutes les espèces étudiées, quelle que soit la voie d’administration, les effets aigus observés (tremblements, ataxie, asthénie, convulsions) traduisent une atteinte du système nerveux central associée à une incoordination motrice (lésions des axones). Lorsque l’animal ne meurt pas, tous les signes sont réversibles en quelques jours.
Par inhalation, des rats exposés à 15,6 mg/m3 d’acrylamide (6 h/j, 5 j/sem, 12 expositions au total sur 16 jours) souffrent d’une perte d’équilibre et de coordination ; aucun effet n’est rapporté chez les chiens et les cobayes exposés de la même manière[6]. Par voie orale, des signes de neuropathie périphérique apparaissent suite à l’administration de 5 doses journalières de 45 ou 75 mg/kg pc/j chez le rat.
Voie
Espèce
DL50/CL50
Orale
Rat
Souris
Cobaye
175 – 413 mg/kg pc
107 – 195 mg/kg pc
180 mg/kg pc
Inhalation
Rat
> 6000 mg/m3
Cutanée
Rat
Lapin
400 mg/kg pc
1148 mg/kg pc
Tableau 2. Toxicité aiguë de l’acrylamide [6, 12]
Irritation, sensibilisation [26]
L’acrylamide est légèrement irritant pour la peau du lapin, induisant l’apparition d’érythème.
L’acrylamide est irritant pour les yeux de lapin : une solution aqueuse à 10 % entraine une légère irritation de la conjonctive, qui disparait totalement après 24 heures. Une solution à 40 % est à l’origine d’une irritation plus sévère de la conjonctive et d’une atteinte de la cornée (opacité, chemosis), réversible après 7 jours.
C’est un sensibilisant cutané pour le cobaye (test de maximisation positif) [1].
Toxicité subchronique, chronique
L’acrylamide est essentiellement un agent toxique pour le système nerveux. Des effets sur les systèmes immunitaire et gastro-intestinal sont aussi rapportés.
Il n’y a pas d’étude sur l’animal après exposition par inhalation ; par voie cutanée les données sont insuffisantes pour pouvoir conclure.
L’exposition des animaux à l’acrylamide par voie orale provoque rapidement l’apparition de signes cliniques de neurotoxicité (perte de l’usage des membres, tremblements et manque d’équilibre) dans toutes les espèces (primates, chiens, chats, rongeurs). À l’examen microscopique, on observe des modifications dégénératives des nerfs périphériques et optique (perte de myéline sur les fibres nerveuses des cellules ganglionnaires et axonales), de la rétine (perte de photorécepteurs – [12]). La plus faible dose sans effet (absence de dégénérescence nerveuse) est 0,5 mg/kg/j pendant 2 ans chez le rat [27]. Ces lésions sont réversibles à l’arrêt de l’exposition après 30 semaines chez les primates et après 5 semaines chez les rongeurs.
Des effets sur le système immunitaire sont rapportés chez des souris femelles (4, 12 et 36 mg/kg pc/j, pendant 30 jours, dans l’eau de boisson) telles que l’atrophie du thymus et de la rate à 36 mg/kg pc/j, l’augmentation du pourcentage de lymphocytes T à toutes les doses et de lymphocytes auxiliaires à 36 mg/kg pc/j, ou la diminution des lymphocytes NK (tueur naturel) à toutes les doses. Une inhibition des immunités humorale et cellulaire est mise en évidence par différents tests à la plus forte dose seulement (respectivement un test d’hémolyse et le test de prolifération induite des splénocytes par une substance mitogène) [28]. Ces effets immunotoxiques sont aussi observés chez le rat, à partir de 30 mg/kg pc/j [29].
Des études récentes ont mis en évidence le rôle potentiel du stress oxydant et de l’apoptose dans la toxicité de l’acrylamide, notamment son immunotoxicité ou son hépatotoxicité. Ainsi, chez des souris exposées à 12,5-25 et 50 mg/kg pc/j d’acrylamide pendant 30 jours, sont observées : une diminution du nombre de cellules sanguines immunitaires (50 mg/kg), une atrophie et des modifications histologiques de la rate (50 mg/kg), une augmentation de la peroxydation lipidique dans le thymus (50 mg/kg) et la rate (25 et 50 mg/kg) et une déplétion en glutathion dans ces 2 organes (25 et 50 mg/kg), une augmentation de l’apoptose des splénocytes (25 et 50 mg/kg) [30].
Au niveau hépatique, l’acrylamide (rat, 25 mg/kg pc/j, 21 jours) induit :
- un stress oxydant caractérisé par une diminution des taux de glutathion et du statut antioxydant total, une augmentation de l’activité de la superoxyde dismutase et de la catalase, et une augmentation de la peroxydation lipidique et du statut oxydant total ;
- une augmentation de l’activité des enzymes hépatiques (AST, ALT, ALP) et, au niveau histologique, la présence d’inflammation, de nécroses et d’hémorragies [31].
D’autres effets sont mentionnés par ailleurs : hyperplasie de l’épithélium alvéolaire et hyperplasie du pré-estomac (chez la souris mâle, 9 mg/kg pc/j, 2 ans), vacuolisation cytoplasmique au niveau du cortex surrénal (rat femelle, 4 mg/kg pc/j pendant 2 ans), congestion et pigmentation de la rate, hyperplasie érythrocytaire dans la moelle osseuse (rat mâle et femelle, 22-26 mg/kg pc/j pendant 13 semaines) [12].
Effets génotoxiques [6, 7, 32]
L’acrylamide est clastogène ; il est mutagène pour les cellules somatiques et germinales des rongeurs, et induit des lésions génétiques héréditaires. Son métabolite principal, le glycidamide, serait responsable de la génotoxicité. L’acrylamide et le glycidamide forment des adduits à l’ADN.
In vitro, l’acrylamide :
- n’est pas mutagène pour les bactéries (test d’Ames, avec ou sans activateurs métaboliques) ;
- est peu ou pas mutagène pour les cellules de mammifère en culture (cellules ovariennes de hamster chinois résultat douteux, V79 négatif, lymphome de souris positif, cellules embryonnaires de souris transgénique positif) ;
- est clastogène avec et sans activateurs métaboliques (aberrations chromosomiques, micronoyaux, échanges entre chromatides sœurs, perturbation du fuseau mitotique : résultats positifs) ;
- induit de façon équivoque des cassures de l’ADN (cellules V79 faiblement positif, hépatocytes de rat négatif, lymphocytes humains négatif) ;
- provoque la transformation cellulaire dans différentes lignées (cellules embryonnaires de hamster syrien, BALB 3T3, NIH 3T3, C3H/10T1/2).
Son métabolite principal, le glycidamide, se fixe à l’ADN et occasionne des réponses positives dans tous ces tests en dehors de la transformation cellulaire (non testé).
In vivo, l’acrylamide provoque chez la drosophile, une augmentation du taux des mutations somatiques et récessives liées au sexe.
Une multitude d’études sont disponibles chez le rongeur (rat et souris), en quasi totalité réalisées avec des mâles. Administré par voie intrapéritonéale (ip), l’acrylamide provoque :
- des mutations et une clastogenèse dans les cellules somatiques : aberrations chromosomiques dans la moelle osseuse (souris, 50 mg/kg), micronoyaux dans la moelle osseuse et sang périphérique (souris, 2 injections de 25 mg/kg ou 1 seule de 50 mg/kg), polyploïdie ou aneuploïdie dans les cellules de la moelle osseuse (souris, 100 mg/kg), mutation génique au niveau de locus précis (souris, 5 injections de 50 mg/kg), échange de chromatides sœurs (splénocytes et lymphocytes de souris, 100 mg/kg), cassures ADN dans cellules de nombreux organes (souris, 125 mg/kg) ;
- des mutations et une clastogenèse dans les cellules germinales : létalité dominante (souris, 5 injections de 40 mg/kg) ; micronoyaux dans les spermatides (souris et rat, 50 mg/kg) et échanges entre chromatides sœurs dans les spermatogonies (souris, 50 mg/kg), aberrations chromosomiques dans les spermatocytes (souris, 100 mg/kg), translocations héréditaires dans les spermatides et spermatocytes (souris, 50 mg/kg) et mutations au niveau des spermatides et des spermatozoïdes (souris), cassures ADN dans les spermatocytes et les spermatides de souris (125 mg/kg).
Le glycidamide induit l’apparition de micronoyaux dans la moelle osseuse de la souris, en relation avec la dose (12 - 50 mg/kg, ip), et à un taux moindre dans celle du rat (50 - 100 mg/kg, ip).
Administré par voie orale à des souris et des rats mâles, l’acrylamide provoque :
- des mutations géniques chez la souris (19 et 98 mg/kg pc/, 4 semaines, cellules germinales testiculaires) et le rat Big Blue (10 mg/kg pc/j, 2 mois, moelle osseuse et thyroïde) ;
- dans les cellules somatiques : polyploïdie ou aneuploïdie dans les cellules de la moelle osseuse de souris (78 mg/kg pc/j, 7 – 21 jours, nourriture), micronoyaux (souris, 12 et 24 mg/kg pc/j, pendant 30 jours), test des comètes positifs chez le rat et la souris, dans de nombreux organes (souris, 4 jours, 12,5 mg/kg pc/j ; rat, foie, 4 semaines, 3,54 mg/kg pc/j) ;
- dans les cellules germinales : létalité dominante (souris : 7,22 mg/kg pc/j, 6 semaines ; rat : 5 mg/kg pc/j, 64 jours), test des comètes positifs chez la souris, dans les cellules germinales testiculaires (souris, 4 jours, 12,5 mg/kg pc/j).
Des adduits glycidamide-ADN sont formés dans le foie, les testicules, les poumons, les reins, le cerveau, la rate, la moelle osseuse, la thyroïde et la glande mammaire de rat et de souris: ils sont détectés dès 1 mg/kg pc/j d’acrylamide au niveau du foie après 14 jours d’exposition [8].
L'acrylamide est classé comme pouvant induire des anomalies génétiques sur les cellules germinales Muta 1B H340 par l’UE.
Effets cancérogènes
L’acrylamide est cancérogène pour de nombreux organes chez le rat et la souris (notamment la thyroïde, les poumons ou les testicules).
Administré par voie orale, l’acrylamide provoque chez le rat (0 - 0,01 - 0,2 - 0,5 - 2 mg/kg/j dans l’eau de boisson pendant 2 ans) une augmentation, chez le mâle, du taux d’adénomes folliculaires de la thyroïde (à la plus forte dose) et de mésothéliomes testiculaires (à partir de 0,5 mg/kg/j) et, chez la femelle à la plus forte dose, des tumeurs de la glande mammaire, du système nerveux central et de la thyroïde (adénome et carcinome) [33].
Plus récemment, des essais de cancérogenèse à long terme ont été menés chez le rat (mâles : 0 – 0,33 – 0,66 – 1,32 – 2,71 mg/kc pc/j ; femelles : 0 – 0,44 – 0,88 – 1,84 – 4,02 mg/kg pc/j, 2 ans) et la souris (mâles : 0 – 1,04 – 2,20 – 4,11 – 8,93 mg/kg pc/j ; femelles : 0 – 1,10 – 2,23 – 4,65 – 9,96 mg/kg pc/j, 2 ans) [12]. Des augmentations dose-dépendantes de l’incidence des nombreuses tumeurs ont été rapportées et elles sont listées dans le tableau suivant.
Espèce
Mâles
Femelles
Dose significative (mg/kg pc/j)
Types de tumeurs
Dose significative (mg/kg pc/j)
Types de tumeurs
Rat
0,33
-
0,44
- Tumeurs de la glande clitoridienne
0,66
-
0,88
- Tumeurs de la glande clitoridienne
- Fibroadénomes de la glande mammaire
1,32 - 1,84 2,71
- Thyroïde : adénomes folliculaires, carcinomes folliculaires, et adénomes/carcinomes folliculaires combinés
- Neurinome cardiaque malin
- Mésothéliomes des testicules et des épididymes
- Adénomes pancréatiques
4,02
- Thyroïde : adénomes folliculaires, carcinomes folliculaires, et adénomes/carcinomes folliculaires combinés
- Tumeurs de la glande clitoridienne
Souris
Dès 1,04
- Adénomes de la glande de Harder
Dès 1,10
- Adénomes de la glande de Harder
Dès 2,20
Dès 2,23
- Glande mammaire : adéno-acanthomes et adénocarcinome combinés
- Adénocarcinomes combinés
Dès 4,11
- Pré-estomac : papillomes, carcinomes, papillomes/carcinomes combinés
Dès 4,65
- Adénomes pulmonaires
8,93
- Adénomes pulmonaires
9,96
- Tumeurs bénignes des ovaires
- Papillomes du pré-estomac
Chez la souris A/J (gavage, 0 - 6,25 - 12,5 - 25 mg/kg ou par voie ip 0 - 1 - 3 - 10 - 30 mg/kg, 3 fois/sem, 8 sem) dans des études de dépistage à court terme, il induit une augmentation du taux et du nombre d’adénomes pulmonaires [34].
Il a également été montré comme agent initiateur de cancérogenèse cutanée (papillomes à cellules squameuses et carcinomes) chez la souris après administration orale, ip ou locale (12 - 25 - 50 mg/kg, 6 fois en 2 sem) et traitement cutané par le TPA (12-O-tétradécanoylphorbol-13-acétate, 1 μg, 3 fois/sem, 20 sem). Aucune tumeur cutanée n’a été observée en l’absence de traitement avec le TPA [34]. Une étude similaire (administration orale, ip ou locale, 0 - 12,5- 25 – 50 mg/kg, 6 fois en 2 sem ; TPA, 2,5 µg, 3 fois/sem, 20 sem) a mis en évidence une augmentation significative de la fréquence des adénomes et carcinomes alvéolaires/bronchiolaires à la plus forte dose, avec ou sans traitement au TPA [35].
L'acrylamide est classé comme cancérogène pour l’homme, Carc. Cat. 1B, H350 par l’UE et probablement cancérogène pour l’homme groupe 2A par le CIRC.
Effets sur la reproduction
L’acrylamide est toxique pour la reproduction : les organes reproducteurs mâles et femelles sont atteints et des modifications génétiques dans le sperme sont rapportées. Concernant les effets sur le développement, une baisse de poids des petits et des effets neurologiques à des doses neurotoxiques pour les mères sont observés. Des modifications des taux de progestérone et de testostérone ont aussi été détectées.
Fertilité
Effets chez le mâle : l’ajout d’acrylamide dans l’eau de boisson pendant plusieurs jours ou sur plusieurs générations engendre chez le rat et la souris une diminution de la taille des portées et une augmentation des pertes pré et post-implantatoires (doses comprises entre 3 et 60 mg/kg pc/j) [6]. L’accouplement d’animaux traités avec des femelles non traitées montre que ces effets seraient dus à une modification du sperme avec pour résultat une diminution du passage des spermatozoïdes du vagin vers l’utérus, une baisse de leur mobilité et de leur vitesse de migration ; la modification génétique (translocation réciproque et mutation génique) atteint les cellules germinales et, en particulier, les spermatides. Les NOAELs sont de 9 - 14 mg/kg/j chez la souris et de 2 - 5 mg/kg/j chez le rat.
La récente étude du NTP [12] rapporte :
- une dilatation des conduits dans les glandes préputiales et une inflammation des glandes elles-mêmes aux 3 plus fortes doses testées (2 ans, eau de boisson) chez le rat et la souris ;
- une dégénérescence des tubules séminifères chez les rats mâles exposés via l’eau de boisson (77 mg/kg pc/j pendant 14 jours ; NOAEL 37 mg/kg) ou via la nourriture (52 mg/kg pc/j pendant 14 jours, NOAEL 22 mg/kg) ; pas d’effet chez la souris ;
- une dégénérescence de l’épithélium germinal testiculaire chez le rat et la souris exposés pendant 13 semaines à 2,8-4,5 et 59-70 mg/kg pc/j, respectivement.
Chez la souris (gavage, 36 mg/kg/j, 2 fois/sem, 8 sem) et le rat (eau de boisson, 20 mg/kg/j, 90 j), on observe une atrophie testiculaire avec diminution du nombre de spermatides, de spermatocytes et de spermatozoïdes et apparition de cellules géantes multinucléées [12].
Chez le rat immature (âgé de 21 jours), l’administration de 0 – 5 ou 10 mg/kg pc/j d’acrylamide, via l’eau de boisson pendant 8 semaines, entraîne un ralentissement de la croissance, une diminution liée à la dose de la concentration spermatique au niveau des épididymes et une hyperplasie des cellules de Leydig à la plus forte dose [36].
Des rats nouveau-nés exposés via l’allaitement pendant 3 semaines puis directement dans l’eau de boisson pendant 9 semaines (dose estimée 4,4 mg/kg pc/j) présentent une dégénérescence de l’épithélium séminifère des testicules et des épididymes (NOAEL = 2,2 mg/kg pc/j)[37].
Effets chez la femelle : une augmentation de la fréquence d’atrophie des ovaires (rat, à partir de 1.84 mg/kg pc/j) et des kystes ovariens (souris, à partir de 4,6 mg/kg pc/j) est rapportée suite à une exposition à l’acrylamide via l’eau de boisson pendant 2 ans [12]. Des études récentes ont mis en évidence des effets néfastes de l’acrylamide sur la maturation des oocytes, chez des souris exposées à 25 mg/kg pc/j d’acrylamide (injections ip, pendant 7 jours), probablement liés à la métabolisation de l’acrylamide en glycidamide (absence d’effet in vitro) [38].
L’ajout de 10 et 50 mg/kg pc/j dans la nourriture, pendant 6 semaines à des souris femelles entraîne une diminution du poids des ovaires (50 mg/kg pc/j), du nombre d’oocytes et de la taille des portées aux 2 doses testées, une augmentation des espèces réactives de l’oxygène présents dans les oocytes et du nombre d’oocytes en apoptose précoce aux 2 doses testées [39]. Une diminution du nombre de corps jaunes, voire même une absence totale à la plus forte dose testée, est rapportée chez des souris exposées à 20 et 40 mg/kg pc/j d’acrylamide pendant 30 jours via l’eau de boisson [40].
L'acrylamide est classé comme susceptible de nuire à la fertilité Repr 2 H361f par l’UE.
Développement
Le traitement des femelles par voie orale pendant la gestation, ou sur une période plus longue incluant la gestation et la lactation, montre que l’acrylamide est toxique pour le développement. Chez la souris femelle, l’acrylamide traverse la barrière placentaire et se distribue dans le fœtus avec accumulation dans la peau au 17e jour de gestation. Il induit une baisse de prise de poids des petits à des doses orales maternelles de 14,5 mg/kg/j chez le rat (eau de boisson, de GD6 à PND21, NOAEL = 7,8 [41] ) et 45 mg/kg/j chez la souris (gavage GD6 à 20, NOAEL = 15 [42]).
Suite à l’ajout de 3 mg/kg pc/j dans eau de boisson à des femelles cobayes gestantes, du 32ème jour de gestation à la fin de la gestation, une diminution du nombre de follicules sains, une atrésie folliculaire et une augmentation du nombre de cellules apoptotiques sont rapportées chez les nouveau-nés[43].
Aux doses induisant une neurotoxicité maternelle chez le rat (10 - 15 mg/kg/j ; gavage des mères pendant la gestation puis des nouveau-nés jusqu’au PND22), on observe une altération de l’activité motrice chez les petits mise en évidence par différents tests (open-field, rotared)[6]. Une altération des performances d’apprentissage est aussi rapportée chez des rats juvéniles, exposés pendant toute la gestation puis via l’allaitement et directement par gavage jusqu’à 12 semaines ou 8 mois (5 mg/kg pc/j)[44, 45]. Une diminution du réflexe de sursaut auditif est mesurée chez des rats nouveau-nés après exposition des femelles gestantes, du 6ème au 10ème jour de gestation, à 5 et 15 mg/kg pc/j d’acrylamide ; le poids des nouveau-nés est aussi diminué à ces doses [46].
Suite à l’exposition de rates à 0.5-2 ou 5 mg/kg pc/j d’acrylamide pendant 10 semaines avant l’accouplement, puis pendant la gestation et la lactation, les mâles adultes de la génération F1 présentent une fragmentation et/ou un gonflement des nerfs périphériques à la plus forte dose testée [47].
De plus, les niveaux de certaines catécholamines (noradrénaline, dopamine, 5-hydroxytryptamine) sont diminués chez des rats nouveau-nés exposés seulement par l’allaitement (25 mg/kg pc/j) [48].
Effets pertubateurs endocriniens
Des rats ont été exposés à l’acrylamide via l’eau de boisson pendant 28 jours. A partir de 19 mg/kg pc/j, une diminution des taux de testostérone et de T3 est mesurée chez les rats mâles ; à 25 mg/kg pc/j, le taux de T4 baisse aussi chez les mâles. Aucune modification n’est rapportée chez les femelles [6].
Chez des souris exposées à 20 et 40 mg/kg pc/j d’acrylamide pendant 30 jours, via l’eau de boisson, une diminution des niveaux en progestérone sérique est mesurée dès 20 mg/kg pc/j, les niveaux en 17 β-œstradiol restant inchangés [40].
Chez le rat immature (âgé de 21 jours), l’administration de 0 – 5 ou 10 mg/kg pc/j d’acrylamide via l’eau de boisson pendant 8 semaines, augmente la testostérone sérique à 5 et 10 mg/kg pc/j [36].
Toxicité sur l’HommeLors d’expositions professionnelles à l’acrylamide, les principaux signes de toxicité aiguë sont une irritation cutanée qui précède presque toujours les signes d’atteinte neurologique. Ce sont les atteintes neurologiques périphériques qui dominent le tableau lors d’expositions chroniques à l’acrylamide, souvent associées à des symptômes cutanés. Les études épidémiologiques menées dans la population professionnellement exposée à l’acrylamide ne retrouvent pas d’excès de risque de cancer tous sites confondus. On ne dispose pas de donnée sur les effets pour la reproduction dans le cadre d’expositions professionnelles.
Toxicité aiguë [2, 7, 49]
En milieu professionnel, les sujets sont principalement exposés par voies inhalatoire et cutanée.
Dans un cas d’intoxication aiguë après ingestion volontaire massive (d’une dose de l’ordre de 375 mg/kg) d’acrylamide, les symptômes sont apparus 5 heures après l’ingestion associant hallucinations avec hypotension, suivies par des convulsions à la 9ème heure, puis au 3ème jour par une détresse respiratoire, une hémorragie digestive et une atteinte neurologique périphérique (persistante 2 mois plus tard) et une atteinte hépatique [7].
Plusieurs cas d’irritation cutanée sont rapportés lors d’expositions professionnelles à l’acrylamide ; les principaux symptômes cutanés décrits sont une irritation, un rash cutané, une desquamation palmaire, une sudation et une dermatose de type acnéiforme de la face et des mains. Ces symptômes précèdent presque toujours les signes d’atteinte neurologique [7, 49].
Plusieurs publications font état de cas d’eczémas de contact, confirmés par des tests épicutanés (patch-tests positifs avec acrylamide en solution dans la vaseline aux concentrations de 0,001% à 5%), touchant les mains, les poignets et parfois la face, chez des travailleuses (biochimiste, technicienne de laboratoire, étudiante en immunologie) exposées pendant plusieurs mois à l’acrylamide lors de l’utilisation de gels d’électrophorèse, ainsi que chez une salariée manipulant depuis 3 mois l’acrylamide dans une usine de plasturgie [7, 49 à 53].
Toxicité chronique
Les études épidémiologiques et les rapports de cas retrouvent systématiquement des atteintes neurologiques périphériques lors d’expositions par voies cutanée et/ou inhalatoire à l’acrylamide ; ces mêmes effets sont apparus lors d’expositions répétées par voie orale.
Les travailleurs exposés à des concentrations supérieures à 0,3 mg/m3 (sur 8 heures) ont une prévalence accrue de symptômes neurologiques périphériques comparés à ceux exposés à moins de 0,3 mg/m3, mais aucune corrélation dose effet n’est établie. De plus, la part de l’absorption cutanée dans l’apparition de ces symptômes ne peut être quantifiée[7].
Plusieurs rapports de cas sont retrouvés dans la littérature mais étant donné le peu d’informations sur l’intensité de l’exposition, il est difficile d’en tirer des conclusions claires. La plupart d’entre eux décrivent des symptômes cutanés à type d’irritation, d’hyperhydrose et de vasodilatation des mains et des pieds (témoins d’une atteinte du système nerveux autonome), suivis quelques mois après par une perte de poids et d’appétit, une asthénie ainsi qu’une atteinte neurologique périphérique ; cette dernière, d’apparition progressive, associe une sensation de faiblesse et d’engourdissement des 4 membres et une diminution de la sensibilité thermique, algique et profonde. Peuvent apparaître des troubles de la coordination des gestes fins et un tremblement des extrémités évocateurs d’une atteinte neurologique centrale. L’examen objective une aréflexie ostéo-tendineuse, voire un nystagmus. Les vitesses de conduction nerveuse peuvent être normales, mais la biopsie nerveuse authentifie dans certains cas une fibrose, une perte de fibres nerveuses de diamètre large. Les symptômes sont le plus souvent totalement réversibles en plusieurs semaines à quelques mois, mais des séquelles sont toutefois possibles. Dans la plupart des cas, les niveaux d’exposition sont mal documentés et aucun examen histopathologique n’a été effectué [7, 49].
Dans les études en milieu professionnel, les auteurs rapportent surtout chez les travailleurs les plus fortement exposés à l’acrylamide, des signes d’irritation cutanée voire oculaire, nasale et respiratoire, qui précèdent les signes d’atteintes neurologiques périphériques parfois de plusieurs semaines. Ces dernières, d’apparition progressive, peuvent apparaître pour des expositions supérieures à 0,3 mg/m3 d’acrylamide et s’associer à une atteinte de la sensibilité profonde, à des troubles cérébelleux avec ataxie et nystagmus. Le rôle de l’exposition par voie dermale dans l’apparition des symptômes cutanés (érythème, desquamation et hypersudation des mains) ainsi que dans l’apparition des signes systémiques est très probable [7, 49, 54].
Plusieurs études ont été publiées par une même équipe norvégienne entre 2004 et 2011 [55 à 58], concernant les effets neurotoxiques chez des salariés ayant été exposés des mois ou des années plus tôt (niveaux d’expositions inconnus), pendant plusieurs années, à l’acrylamide et au N-méthylolacrylamide contenus dans un mastic utilisé dans le cadre de travaux d’étanchéité d’un tunnel. Les électromyogrammes réalisés dans l’étude initiale, ont permis de mettre en évidence une diminution faible mais significative des vitesses de conduction sensitive et une augmentation de la latence distale du nerf cubital, 4 mois après la fin de l’exposition, ainsi qu’une diminution des amplitudes du nerf médian. Les perturbations observées sont compatibles avec une démyélinisation des axones des fibres nerveuses sensitives et motrices des nerfs périphériques. Ces anomalies étaient partiellement réversibles 16 mois après arrêt de l’exposition. Les études ultérieures ont permis de confirmer l’atteinte des nerfs périphériques (réduction des vitesses de conduction sensitive et de l’amplitude du nerf saphène externe). Une légère diminution de la sensibilité à la lumière et de la discrimination des couleurs, ainsi que des anomalies lors des potentiels évoqués visuels (augmentation de la latence de l’onde N75) et de l’électrorétinographie (diminution de l’amplitude lors de la stimulation des cônes à 30 Hz) étaient par ailleurs mis en évidence, en faveur d’une altération de la fonction des cônes de la partie centrale de la rétine.
Effets perturbateur endocrinien [19]
L’effet perturbateur endocrinien de l’acrylamide a été examiné dans deux études épidémiologiques récentes. La première a été réalisée à partir du registre des infirmières aux Etats-Unis et n’a pas permis de mettre en évidence une association positive entre l’exposition à l’acrylamide via l’alimentation et les concentrations des hormones sexuelles susceptibles de jouer un rôle dans l’étiologie de pathologies (endométriose, cancers des ovaires et du sein) suspectées être liées à l’acrylamide [59]. La seconde étude, japonaise, a en revanche établi un lien entre l’absorption d’acrylamide via l’alimentation, la baisse significative d'œstradiol et l’augmentation de FSH chez des femmes japonaises non ménopausées [60]. D’autres études sont nécessaires afin de confirmer ou non ces effets.
Effets génotoxiques [7, 32, 61]
Chez les sujets exposés à l’acrylamide, des adduits à l’hémoglobine, N-(2-carboxyéthyl)valine et N-(2-carboxy-2-hydroxyéthyl)valine, sont formés.
Dans une étude norvégienne publiée en 2005, une fréquence accrue de lacunes chromatidiques a été mise en évidence dans les lymphocytes circulants de 25 tunneliers exposés à l’acrylamide et au N-méthylolacrylamide contenu dans un mastic d’étanchéité, comparativement à 25 témoins non-exposés appariés sur l’âge, le sexe et le tabagisme. Il n’était pas observé de différence entre les 2 groupes concernant les aberrations et les cassures chromosomiques. La responsabilité de l’acrylamide n’est pas évaluable compte tenu de la coexposition au N-méthylolacrylamide [62].
Effets cancérogènes [2, 7, 32, 49, 63]
Deux études de cohorte ont analysé les causes de décès de travailleurs exposés à l’acrylamide.
La première étude de mortalité concerne 371 sujets exposés depuis les années 1955 jusqu'en 1979 dans une fabrique d’acrylamide et de polyacrylamide aux États-Unis, à des niveaux allant de 0,1 à 1 mg/m3 avant 1957 ; de 0,1 à 0,6 mg/m3 entre 1957 et 1970 puis inférieurs à 0,1 mg/m3. Après exclusion des sujets ayant été exposés aux colorants organiques, aucun excès significatif de mortalité par cancer n’est observé [64]. À noter le faible nombre de sujets exposés, la durée d’exposition et la latence trop courte dans cette étude, qui rendent difficile l’interprétation de ces résultats [7]. Dans une analyse plus récente [65], en tenant compte des salariés exposés entre 1979 et 2001 (portant le nombre total de sujets à 696), aucun des rapports standardisés de mortalité par cancer spécifique n’est statistiquement significatif, malgré un nombre de décès par cancer du pancréas plus élevé que prévu (5 versus 2,3).
Une deuxième étude de mortalité a été menée aux États-Unis et aux Pays-Bas chez 8854 travailleurs ayant été exposés entre les années 1925 et 1983 à l’acrylamide à des doses cumulées supérieures à 0,001 mg/m3 année comparés à 8 094 témoins non exposés. Cette étude a été étendue jusqu’en 2002 (soit 1093 morts supplémentaires) pour la cohorte totale tandis que la cohorte américaine a fait l’objet d’un suivi complémentaire de 11 ans jusqu’en 1994. Cette étude ne retrouve pas d’excès significatif de mortalité par cancer, ni d'excès de mortalité toutes causes confondues. Seul un excès significatif de risque de cancer du pancréas (SMR = 2,26 ; CI 1,03 - 4,29) chez les sujets ayant une exposition cumulée à l’acrylamide supérieure à 0,30 mg/m3 année, est retrouvé dans la cohorte américaine suivie jusqu’en 1994, sans relation dose réponse ; à noter que cet excès de risque est non significatif lors de l’étude sur la cohorte complète. Par ailleurs, l’information sur le niveau d’exposition (et en particulier sur l’exposition cutanée) dans cette étude est peu documentée [66, 67].
La méta-analyse de ces 2 études de cohorte ne montre pas d’excès de risque statistiquement significatif de mortalité par cancer tous sites confondus et quel que soit le site [68].
De nombreuses études ont recherché un excès de risque de cancer associé à l’exposition à l’acrylamide du fait de l’alimentation. Une méta-analyse de 10 études publiées au cours des années 2000 n’a pas montré d’excès de risque de cancer augmentant avec la dose estimée d’acrylamide dans l’alimentation [68]. Une autre méta-analyse récente de 32 études publiées entre janvier 2009 et juillet 2014 a estimé les risques relatifs (RR) de cancer chez les individus les plus exposés, comparés aux moins exposés. Le seul site pour lequel le RR est à la limite de la significativité est le cancer du rein (RR=1,2 ; IC 95% : 1-1,45). Dans le sous-groupe des non-fumeurs, des excès de risque à la limite de la significativité sont en outre observés pour les cancers de l’utérus (RR=1,23 ; IC 95% : 1-1,51) et de l’ovaire (RR=1,39 ; IC 95% : 0,97-2) [69].
Effets sur la reproduction
Aucune étude n’a été publiée concernant de possibles effets sur la reproduction chez l’Homme, dans le cadre d’expositions professionnelles. Plusieurs études récentes[70 à 73] réalisées au niveau de différents pays de l’Union européenne ont mis en évidence une association inverse entre différents paramètres de croissance fœtale (poids de naissance, taille à la naissance, périmètre crânien) et l’apport d’acrylamide via l’alimentation chez des femmes enceintes (exposition estimée sur la base de questionnaires sur l’alimentation +/- dosages des adduits acrylamide-hémoglobine ou glycidamide-hémoglobine au niveau du sang du cordon ombilical).
Cohérence des réponses biologiques chez l'Homme et l'animal
