Prélèvement : Actif sur cassette ouverte ou porte-filtre pour tête GELMAN®
Analyse : MOCP
Données de validation : Validation non disponible
Substances
Informations générales
Propriétés physico-chimiques
| Nom | N° CAS | Formule chimique | Classification CMR |
|---|---|---|---|
| Fibres |
Plus d'informations
| Nom | Masse molaire | Densité | Synonymes | Fiche toxicologique |
|---|---|---|---|---|
| Fibres |
FT Fibres de verre à usage spécial
|
Familles de substances
- FIBRES
Principe et informations
La méthode s'applique à toutes les fibres présentes en suspension dans l'air des lieux de travail, à l’exception de l’amiante.
Les fibres retenues pour le comptage sont les fibres de longueur supérieure à 5 µm, de rapport longueur/largeur supérieur à 3 et de largeur au plus égale à 3 µm.
Cette méthode est utilisable pour mesurer la concentration des fibres en suspension dans l’air,
qu’il s’agisse de fibres d’origine naturelle ou de fibres artificielles. Elle ne permet d'identifier ni la composition, ni les caractéristiques de certains types de fibres. La nature des fibres est déterminée par d'autres techniques (microscopie électronique à balayage, à transmission…).
Pour plus d'information sur les fibres consulter le dossier INRS - Fibres autres que l’amiante.
Principe de prélèvement et d'analyse
-
État physique
Particules en suspension (liquides ou/et solides) -
Type de prélèvements
Actif -
Nom du dispositif
cassette ouverte ou porte-filtre pour tête GELMAN® -
Plus d'informations
-
Technique analytique
MICROSCOPIE OPTIQUE A CONTRASTE DE PHASE
Méthode de prélèvement
Principe général et mise en œuvre pratique du prélèvement
Un dispositif de prélèvement :
Dispositif N°1
-
Type dispositif
SYSTEME PORTE-FILTRE 25 mm OUVERT -
Support ou substrat de collecte
- MEMBRANE FILTRANTE QUADRILLEE ESTER DE CELLULOSE inf 1,2 µm
-
Préparation du substrat
- Avant préparation des systèmes porte-filtre, les lots de filtres utilisés doivent avoir subi une vérification préalable de chaque lot fabricant sur au moins 1 filtre pour 1 000 conduisant à un maximum de 3 structures fibreuses sur 1 mm2 pour 100 champs.
- 2 dispositifs de prélèvement peuvent être utilisés : le système porte-filtre 25 mm pour tête Gelman ou la cassette ouverte, 3 pièces, 25 mm, col court, matériau conducteur.
-
Commentaires, conseils et consignes
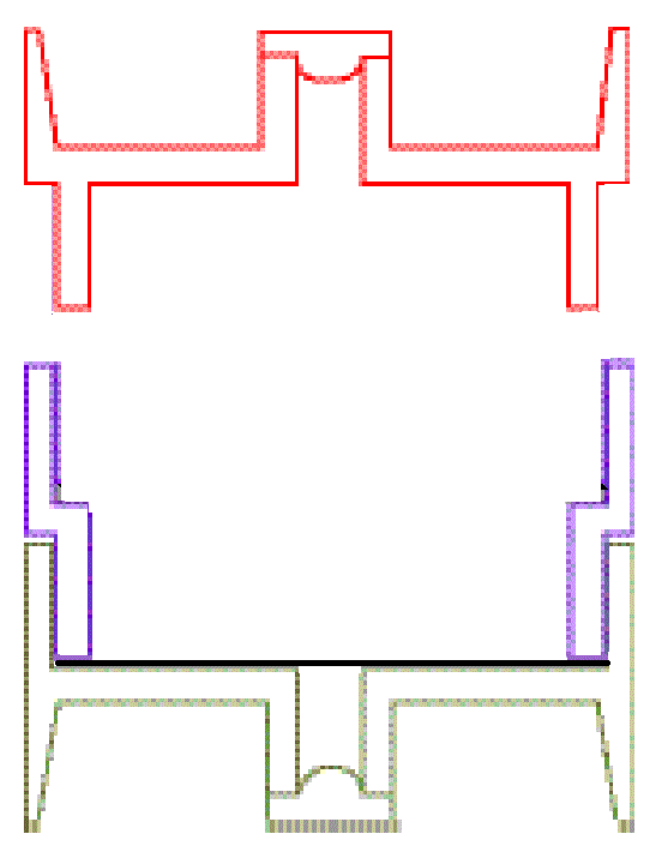
Schéma des dispositifs :
Tête Gelman :
- Vérifier que le joint en PTFE est bien mis en place en contrôlant l'étanchéité du système porte-filtre à l'aide du montage décrit dans le guide de Préparation des dispositifs de prélèvement en vue d'une intervention en entreprise partie : "Assemblage de cassettes et étanchéité"
- Une membrane filtrante quadrillée en nitrate de cellulose de diamètre de pores ≤ 1,2 µm peut aussi être utilisée.
Cassette ouverte, 3 pièces, 25 mm, col court, matériau conducteur :
Conditions de prélèvement
-
Débit de prélèvement mini (L/min)
1 -
Débit de prélèvement maxi (L/min)
2
Pompe de prélèvement
- Pompe à débit de 1 à 3 L/min
Méthode d'analyse
Principe général de l'analyse en laboratoire
Préparation d'analyse
-
Conditions de conservation avant analyse
Pour assurer la conservation des échantillons sur une longue période, il est conseillé de déposer un vernis autour de la lamelle.
-
Conditions de conservation échantillon préparé avant analyse
Une étape de préparation :
Étape de préparation N°1
-
Solvant ou solution
- ACETONE
- TRIACETINE
-
Type de préparation
Transparisation -
Autres conditions de préparation
- Avant le traitement des échantillons, nettoyer le matériel requis. Les lames et lamelles couvre-objet seront nettoyées à l'aide de papier optique (ou papier de soie) juste avant utilisation. Essuyer le scalpel et les pinces à l'aide de papier optique et renouveler les opérations entre chaque échantillon. Tout le matériel utilisé sera stocké sur une surface propre.
- Le traitement d'un filtre entier est préférable. Toutefois, il est possible de découper le filtre au scalpel et d'effectuer l'analyse seulement sur un secteur du filtre (par exemple si l'identification de fibres est nécessaire, le filtre peut être découpé en deux, une moitié sera analysée en microscopie électronique et l'autre en microscopie optique). Une analyse pour identification des fibres par MEB, est également possible en parallèle sur un autre filtre dont les conditions de prélèvement auront été identiques.
- Les filtres prélevés sont rendus transparents suivant le mode opératoire ci-dessous :
- placer la membrane, poussières vers le haut, sur une lame de microscopie,
- effectuer un premier traitement à l'acétone : il consiste à exposer la lame à des vapeurs d'acétone pendant quelques secondes sans excès de vapeur, qui provoquerait la destruction de la membrane par dissolution. Prendre soin qu'aucune goutte d'acétone liquide ne tombe sur la membrane.
- Cette opération peut-être réalisée avec un vaporisateur d'acétone.
- Traiter ensuite la membrane à la triacétine (triacétate de glycérol) filtré en plaçant une à trois gouttes de triacétine sur la lamelle. Retourner la lamelle délicatement en l'inclinant progressivement sur le filtre.
- Attendre plusieurs heures avant l'analyse pour obtenir la réaction complète du filtre avec la triacétine. Toutefois, le chauffage de l'échantillon à environ 50°C pendant 15 min permet l'analyse immédiate.
-
Filtration
La triacétine (triacétate de glycérol) doit être préalablement filtrée sur filtre nuclépore de diamètre de pores 0,2 µm.
-
Commentaires
Traiter les échantillons servant de blancs de laboratoire et de blancs de terrain de la même façon.
Commentaires, conseils, conditions particulières
Des différences de comptage peuvent être observées suivant : la qualité du microscope, l'opérateur, les conditions de travail (contrainte d'ergonomie, d'éclairage…).
La présence de plaquettes ou objets aciculaires sur le filtre rend le comptage problématique.
La densité de fibres sur le filtre conditionne la précision de la mesure. Plus la densité est faible, plus le coefficient de variation du comptage sera élevé. A l’inverse, une densité de fibres trop élevée peut rendre difficile le dénombrement des fibres. Des densités comprises entre 20 et 650 fibres/mm2 sont acceptables.
En pratique, si l’on veut éviter un chargement trop élevé, il convient d’arrêter le prélèvement dès que le filtre commence à se colorer.
Une condition analytique :
Condition analytique N°1
-
Technique analytique
- MICROSCOPIE OPTIQUE A CONTRASTE DE PHASE
-
Commentaires, conseils ou condition particulières
Matériel analytique
- Microscope optique avec :
- éclairage de Kœhler,
- condenseur de contraste de phase de type Abbe ou achromatique,
- platine mécanique munie de porte-lame et d'un déplacement x-y,
- objectifs achromatiques à contraste de phase de grossissement 10 X et 40 X,
- 2 oculaires permettant un grossissement total d'environ 400 à 600 X,
- réticule G22 de Walton et Beckett,
- télescope auxiliaire ou lentille de Bertrand,
- filtre vert,
- micromètre de platine.
- Lame et lamelle couvre-objet.
- Compteurs manuels.
Réglage du microscope
Réglage du réticule
Placer un échantillon sur la platine du microscope. Régler la netteté du réticule avec le tirage de l'oculaire et la netteté de l'image en jouant sur la mise au point du microscope.
Réglage de l'éclairage de Köhler
Placer le condenseur en position haute, ouvrir le diaphragme d'ouverture et fermer le diaphragme de champ pour qu'il apparaisse. Faire varier la position du condenseur de telle sorte que les bords du diaphragme soient aussi nets que possible. Centrer l'optique du condenseur et ouvrir le diaphragme de champ pour qu'il disparaisse du champ de vision.
Réglage du contraste de phase
Introduire l'anneau de phase et faire coïncider son image avec l'anneau d'absorption de l'objectif.
Etalonnage du réticule oculaire
Effectuer la mise au point sur les divisions d'un micromètre. Superposer le réticule oculaire aux divisions du micromètre et déterminer le diamètre réel du champ d'observation (nombre entier de division + estimation éventuelle de la fraction restante).
Comptage et dimensionnement des fibres
- Examiner dans un premier temps le filtre à faible grossissement, avec un objectif de 10 X (grossissement total de 100 à 150 X).
- Vérifier que le bord du filtre est exempt de poussières et que la répartition est homogène sur toute la surface du filtre. Noter les éventuelles différences de densité ou la présence d'agrégats grossiers de fibres ou de poussières.
- Passer à l'objectif 40 X et effectuer la mise au point sur les poussières ou sur le quadrillage. Choisir des champs d'observation au hasard sur la surface exposée du filtre et qui ne se chevauchent pas.
- Ne pas sélectionner les champs :
- incluant des lignes de quadrillage,
- recouverts d'agglomérats,
- situés à moins de 4 mm du bord du filtre ou 2 mm de la ligne de découpe.
Critère de comptage des fibres
Afin de s'assurer que des divergences mineures résultant du dépôt aléatoire des fibres ne faussent pas la mesure, il convient de compter au moins 100 fibres en évaluant au minimum 20 champs ou 100 champs. L’observation d’un nombre de champs supérieur à 100 n’a d’intérêt que l’abaissement de la SA en l’absence de fibres détectées. L’observation de 200 champs est un maximum.
- Seules sont comptées les fibres répondant aux caractéristiques suivantes :
- longueur supérieure à 5 µm,
- rapport longueur/diamètre supérieur à 3,
- diamètre inférieur à 3 µm.
Remarque : On pourra également compter séparément les fibres de diamètre supérieur à 3 µm.
- Les fibres entièrement contenues à l'intérieur du réticule sont comptées pour deux extrémités. Les fibres dont une seule extrémité se trouve à l'intérieur du réticule sont comptées pour une.
- Un agglomérat de fibres qui, en un ou plusieurs points de sa longueur, semble homogène alors qu'en d'autres points il semble se ramifier est appelé fibre dédoublée. On appelle faisceau tout agglomérat de fibres se touchant ou se croisant.
- Une fibre dédoublée est comptée comme une fibre si elle répond aux trois critères dimensionnels précédemment cités, le diamètre étant mesuré au niveau du tronc principal.
- Les fibres en faisceau sont évaluées individuellement si on peut les distinguer suffisamment pour déterminer qu'elles satisfont aux critères dimensionnels. Si l'on ne peut distinguer aucune fibre répondant à la définition, on doit évaluer le faisceau en tant que fibre individuelle si, globalement, il répond à ces critères.
- Les fibres au contact de particules sont comptées comme si les particules n'étaient pas attachées à la fibre.
- Si plus du 1/8ème de la surface du réticule est couvert par un agglomérat de fibres et/ou de particules, passer à un autre champ.
Remarque : Le nombre de fibres sera déterminé en comptant le nombre d'extrémités et en le divisant par 2.
Exemples d'application
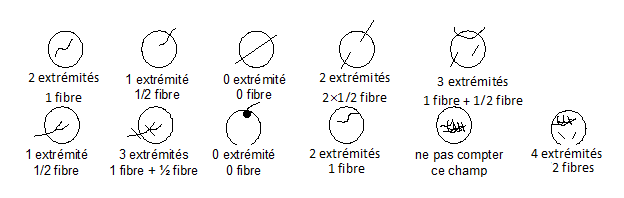
Étalonnage et expression des résultats
La méthode d'étalonnage indiquée est celle utilisée lors du développement. Elle n'a cependant pas de caractère obligatoire
-
Calcul de la quantité de substance sur le dispositif
Calcul de la surface effective de filtration(s)
- Transpariser un filtre coloré par un dépôt de poussière sur la surface. Mesurer (à l'aide du vernier de la platine du microscope ou système équivalent), à 0,2 mm près, au moins 4 diamètres de la tache ainsi formée. Si les diamètres mesurés ne diffèrent pas de plus de 1 mm, calculer la moyenne arithmétique des diamètres. Reproduire sur 3 filtres les opérations précédentes. Si les diamètres des différents filtres ne diffèrent pas de plus de 1 mm, calculer la moyenne arithmétique des diamètres des 3 filtres et en déduire la surface effective de filtration.
- Répéter cette mesure tous les ans, si la nature du filtre ou du système porte-filtre (ou la méthode de transparisation) est modifiée.
Calcul de la concentration en fibres
La concentration de fibres pour chaque prélèvement est déterminée suivant la formule :
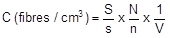
avec : S (en mm2) : surface effective de filtration
s (en mm2) : surface du réticule
N : nombre total de fibres comptées
n : nombre de champs observés
V (cm3) : volume d'air prélevé.
Remarque : L'intervalle de confiance sur le résultat est calculé dans l'hypothèse de la validité de la loi de distribution de Poisson (à 95 %, l'écart est d'environ 20 % sur cent fibres comptées et environ 35 % pour quarante fibres comptées).
Bibliographie
NF X 43-269. Décembre 2017. Qualité de l’air – Air des lieux de travail – Prélèvement sur filtre à membrane pour la détermination de la concentration en nombre de fibres par les techniques de microscopie : MOCP, MEBA et META – Comptage par MOCP. La Plaine Saint-Denis, AFNOR 2017, 63 p.
Historique
| Version | Date | Modification(s) faisant l’objet | Paragraphes |
|---|---|---|---|
| 054 |
| Création et mise à jour |
|
| 054/V01 | 31/08/2007 | Nouvelle présentation |
|
| 054/V01.1 | 17/10/2007 | Valeur limite réglementaire | Substances mesurables |
| 054/V01.02 | 31/03/2008 | Substances et valeurs limites réglementaires Remarque pour les fibres naturelles et artificielles Débit Remarques sur les densités de fibres sur le filtre acceptables Montage pour transparisation du filtre supprimé (technique obsolète) (n) dans la formule de calcul | Substances mesurables Matériel de prélèvement Interférences et limites de la méthode Traitement des échantillons Calcul de la concentration en fibres |
| 054/V02.01 | 31/03/2013 | Modification suite au nouveau décret n°2012-936 concernant l’amiante Révision de la terminologie | Substances mesurables Prélèvement Bibliographie |
| M-309/V01 | Février 2016 | Mise en ligne Prélèvement sur cassette pour tête GELMAN® Analyse MOCP |
|
| M-309/V02 | Novembre 2021 | Mise à jour suite à la révision des normes NF X 43-269 et NF X 43-050 | Tous |
Date de mise à jour : novembre 2021
Ancien numéro de fiche MétroPol : 054
