Prélèvement : Actif sur cassette avec filtres imprégnés ; barboteur
Analyse : spectrophotométrie ; HPLC phase inverse détection UV
Données de validation : Validation partielle
Substances
Informations générales
Propriétés physico-chimiques
| Nom | N° CAS | Formule chimique | Classification CMR |
|---|---|---|---|
| Acide peracétique | 79-21-0 | C2H4O3 |
|
| Peroxyde d'hydrogène | 7722-84-1 | H2O2 |
|
Plus d'informations
| Nom | Masse molaire | Densité | Synonymes | Fiche toxicologique |
|---|---|---|---|---|
| Acide peracétique | 76,05 | 1,15 | ||
| Peroxyde d'hydrogène | 34,01 | Eau oxygénée |
Principe et informations
Cette méthode permet de doser l'acide peracétique et le peroxyde d'hydrogène, ces deux substances étant présentes simultanément lors de l'utilisation des solutions de stérilisation à froid (industries alimentaires ou milieu hospitalier).
Un filtre imprégné d'oxysulfate de titane retient sélectivement le peroxyde d'hydrogène. L'acide peracétique quant à lui est prélevé par barbotage dans une solution de méthyl-p-tolylsulfure (MTS).
Après désorption immédiate des filtres, le complexe coloré Ti-H2O2 est dosé par spectrophotométrie visible. Les produits des réactions d'oxydation (MTSO dans la solution de barbotage) sont analysés par chromatographie en phase liquide.
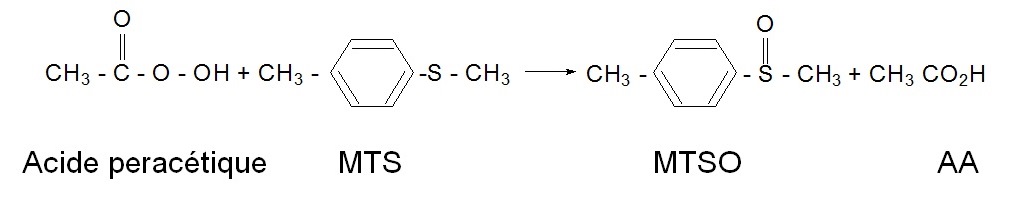
Principe de prélèvement et d'analyse
-
État physique
Aérosols (mélange de gaz ou vapeurs / particules) -
Type de prélèvements
Actif -
Nom du dispositif
cassette avec filtres imprégnés ; barboteur -
Plus d'informations
Réactifs
- ACETONITRILE
- ACIDE SULFURIQUE
- CARBONATE DE SODIUM
- EAU
- ETHANOL
- METHANOL
- METHYL-p-TOLYLSULFOXYDE(MTSO)
- METHYL-p-TOLYLSULFURE(MTS)
- OXYSULFATE DE TITANE
- PEROXYDE D'HYDROGENE
Méthode de prélèvement
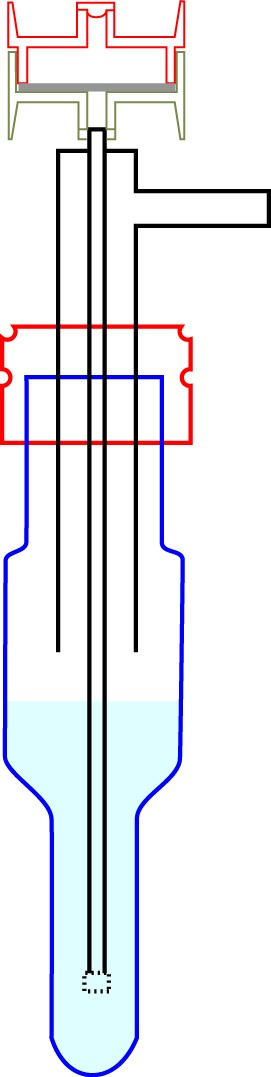
Deux dispositifs de prélèvement (en série) :
Dispositif N°1
-
Type dispositif
CASSETTE 25 mm 2 pièces -
Support ou substrat de collecte
- 2 FILTRES EN FIBRE DE QUARTZ IMPREGNES
-
Préparation du substrat
Solution d'imprégnation : 2,1 g d'oxysulfate de titane dans 25 mL d'acide sulfurique 1,8 M. Chauffer sous agitation jusqu'à obtention d'une solution limpide. Après refroidissement ajouter à 25 mL d'eau et jauger à 50 mL
Imprégner les filtres par deux à l'aide de 210 µL de solution. Sécher à l'étuve pendant 2 heures à 60 °C
-
Commentaires, conseils et consignes
Deux filtres imprégnés sont déposés au fond de la cassette.
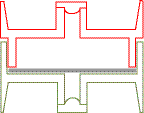
Dispositif N°2
-
Type dispositif
BARBOTEUR -
Support ou substrat de collecte
- SOLUTION DE METHYL-p-TOLYLSULSURE (MTS)
-
Préparation du substrat
Préparer une solution 10 mM de MTS ( 1,38 g/L) dans un mélange éthanol /eau 75/25. Pour cela dissoudre le méthyl-p-tolylsulfure dans quelques mL d'éthanol et diluer ensuite.
-
Commentaires, conseils et consignes
Les barboteurs sont remplis avec 15 mL de solution réactive.
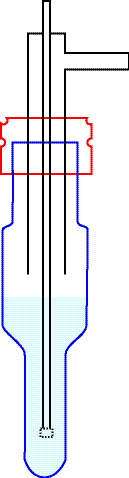
Schéma du dispositif en série
Conditions de prélèvement
-
Débit de prélèvement (L/min)
1 -
15 minutes (VLEP-CT possible dans ces conditions)
oui -
Temps de prélèvement maximum en heures
8
Pompe de prélèvement
- Pompe à débit de 1 à 3 L/min
Conditionnement particulier
-
Choix conditionnement particulier
désorption immédiate
Compléments
Les filtres devront être utilisés dans les 4 semaines après leur imprégnation.
Les filtres doivent être désorbés immédiatement après le prélèvement.
Préparation des dispositifs de prélèvement en vue d’une intervention en entreprise
Méthode d'analyse
Principe général de l'analyse en laboratoire
Préparation d'analyse
-
Conditions de conservation avant analyse
Les filtres doivent être désorbés par 5 mL d'acide sulfurique (1M) immédiatement après le prélèvement.
-
Séparation des dispositifs
oui -
Nombre d'étapes de préparation
2 -
Commentaires sur les étapes
La première étape décrit la traitement des cassettes.
La deuxième étape décrit le traitement des barboteurs.
-
Durée de conservation échantillon préparé avant analyse
1 mois -
Conditions de conservation échantillon préparé avant analyse
La solution de désorption et la solution dans le barboteur sont stables environ 1 mois.
2 étapes de préparation :
Étape de préparation N°1
-
Solvant ou solution
- ACIDE SULFURIQUE
-
Type de préparation
Percolation -
Volume
5 mL -
Autres conditions de préparation
Immédiatement après prélèvement, les 2 filtres sont désorbés directement dans la cassette par percolation
de 5 mL d'H2SO4 (1 M). Récupérer la totalité du solvant par refoulement à l'aide d'une seringue ou déterminer le volume exact de solvant utilisé (par pesée du flacon de recueil avant et après percolation).
Étape de préparation N°2
-
Solvant ou solution
- ACETONITRILE
- ELUANT
-
Volume
25 mL -
Autres conditions de préparation
La solution de barbotage est transférée en fiole jaugée. Le barboteur est rincé à l'acétonitrile ou à l'aide de l'éluant chromatographique, celui-ci étant récupéré également dans la fiole. Le volume est alors ajusté à 25 mL à l'aide d'éluant.
Deux conditions analytiques :
Condition analytique N°1
-
Technique analytique
- SPECTROPHOTOMETRIE
-
Commentaires, conseils ou condition particulières
ʎ : 410-415nm.
Condition analytique N°2
-
Technique analytique
- CHROMATOGRAPHIE EN PHASE LIQUIDE
-
Injecteur
- PASSEUR AUTOMATIQUE
-
Colonne
- PHASE INVERSE C18
-
Détecteur
- ULTRAVIOLET (UV)
-
Phase mobile
- ACETONITRILE
- EAU TAMPONNEE
Étalonnage et expression des résultats
La méthode d'étalonnage indiquée est celle utilisée lors du développement. Elle n'a cependant pas de caractère obligatoire
-
Principe d'étalonnage
externe -
Solvant de l’étalon
- ACETONITRILE
- ACIDE SULFURIQUE
- EAU
- ELUANT
-
Commentaires
Dosage du peroxyde d'hydrogène
Réaliser une gamme d'étalonnage dans la même matrice que les échantillons à analyser. La réponse est linéaire jusqu'à une concentration de 30 mg/L de H2O2.
Dosage de l'acide peracétique
L'étalonnage externe est pratiqué avec des étalons réalisés à partir d'une solution de méthyl-p-tolylsulfoxyde (MTSO).Pour le dosage des solutions de barbotage, préparer une solution-mère de méthyl-p-tolylsulfoxyde (MTSO) dans le méthanol, puis une série de solutions étalons par dilution de cette solution-mère dans l'éluant chromatographique.
-
Calcul de la quantité de substance sur le dispositif
Pour le calcul de la concentration atomsphèrique en peroxyde d'hydrogène, se référer au lien ci dessus.
La concentration atmosphèrique en acide peracétique dans l’atmosphère est donnée par :
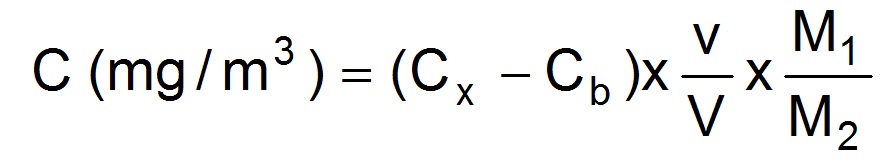
avec : Cx (mg/L) : concentration de MTSO dans la solution échantillon analysée
Cb (mg/L) : moyenne des concentrations de MTSO dans les blancs de laboratoire
v (mL) : volume de la solution analysée
V (L) : volume d’air prélevé
M1 (g/mol) : masse moléculaire de l'acide peracétique
M2 (g/mol) : masse moléculaire du méthyl-p-tolylsulfoxyde (MTSO)
Compléments
Voir exemple de condition chromatographique dans données de validation - complément
Bibliographie
- F. Gagnaire, B. Marignac, G. Hecht and M. Héry - Sensory Irritation of Acetic Acid, Hydrogen Peroxyde, Peroxyacetic acid and their Mixture in Mice. Ann. occup. Hyg., 2002, vol. 46, n°1, pp. 97-102,.
- S. Effkemann et al. - Determination of gas phase peroxyacetic acid using pre-column derivatization with organic sulfide reagents and liquid chromatography. Journal of chromatography A. 855 (1999), pp. 551-561.
- C. S. Christensen et al. - Determination of hydrogen peroxide in workplace air: interferences and method validation. J. Environ. Monit., 2000, 2, pp. 339-343.
- G. Hecht et al. - Workplace monitoring of hydrogen peroxyde using titanyl-coated sorbents. J. Environ. Monit., 1999, 1, pp. 149-152.
Historique
| Version | Date | Modification(s) faisant l’objet | Paragraphes |
|---|---|---|---|
| 068 | Jusqu’au 28/11/07 | Création et mises à jour |
|
| 068/V01 | 28/11/07 | Nouvelle présentation |
|
| 068/V01.01 | 31/01/09 | Remplacement de la notation VLE par VLCT Description de la cartouche SPE | Substances mesurables Echantillonneur (PRELEVEMENT) |
| 068/V01.02 | 15/07/2013 | Révision de la terminologie | Tous |
| M-213/V01 | Novembre 2015 | Mise en ligne 2 Substances présentent simultanément Prélèvement sur cassette + barboteur Analyse par spectrophotométrie |
Date de mise à jour : novembre 2015
Ancien numéro de fiche MétroPol : 068
