Prélèvement : Actif sur cassette avec filtres imprégnés
Analyse : électrophorèse capillaire
Données de validation : Validation non disponible
Substances
Informations générales
Propriétés physico-chimiques
| Nom | N° CAS | Formule chimique | Classification CMR |
|---|---|---|---|
| Anhydride sulfureux | 7446-09-5 | SO2 |
|
Plus d'informations
| Nom | Masse molaire | Densité | Synonymes | Fiche toxicologique |
|---|---|---|---|---|
| Anhydride sulfureux | 64,06 | Dioxyde de soufre |
Familles de substances
- ANIONS MINERAUX
Principe et informations
Les particules éventuellement présentes dans l’aérosol sont collectées sur un premier filtre (en général une membrane de faible porosité) et l’anhydride sulfureux gazeux est recueilli sur le second filtre imprégné d’hydroxyde de potassium. À la désorption, l’anhydride sulfureux est oxydé en sulfates qui sont alors dosés par chromatographie ionique ou électrophorèse capillaire.
Principe de prélèvement et d'analyse
-
État physique
Gaz et vapeurs -
Type de prélèvements
Actif -
Nom du dispositif
cassette avec filtres imprégnés -
Plus d'informations
-
Technique analytique
ELECTROPHORESE CAPILLAIRE -
Injecteur
PASSEUR AUTOMATIQUE -
Détecteur
ULTRAVIOLET (UV)
Réactifs
- ACIDE BORIQUE
- ACIDE TRIFLUOROACETIQUE
- CHROMATE DE SODIUM TETRAHYDRATE
- EAU
- EAU OXYGENEE
- HYDROXYDE DE POTASSIUM
- MODIFICATEUR DE FLUX ELECTROOSMOTIQUE
- SOLUTION ETALON 1g/L
Méthode de prélèvement
Utilisation de la cassette fermée pour le prélèvement d’aérosols
Un dispositif de prélèvement :
Dispositif N°1
-
Type dispositif
CASSETTE 37 mm 3 pièces -
Support ou substrat de collecte
- FILTRE FIBRE DE QUARTZ IMPREGNE
- MEMBRANE inf 1 µm
- TAMPON EN CELLULOSE
-
Préparation du substrat
Imprégner les filtres en fibre de quartz avec une solution à 9,6 g d'Hydroxyde de potassium pour 100 mL d'eau, soit en les trempant soit en déposant 500 µL de solution. Faire sécher à l'étuve à 50°C.
-
Commentaires, conseils et consignes
Le filtre en fibre de quartz imprégné est déposé au fond de la cassette et la membrane sur la pièce intermédiaire juste au dessus du tampon de cellulose.
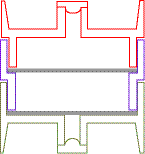
Conditions de prélèvement
-
Débit de prélèvement (L/min)
1 -
15 minutes (VLEP-CT possible dans ces conditions)
oui -
Temps de prélèvement maximum en heures
8
Pompe de prélèvement
- Pompe à débit de 1 à 3 L/min
Compléments
Les filtres imprégnés peuvent être conservés 3 mois avant utilisation.
Si l'analyse des métaux est souhaitée conjointement avec SO2, le filtre membrane et le tampon peut être remplacé par un filtre en fibre de quartz vierge.
Préparation des dispositifs de prélèvement en vue d’une intervention en entreprise
Méthode d'analyse
Principe général de l'analyse en laboratoire
Préparation d'analyse
-
Nombre d'étapes de préparation
3 -
Commentaires sur les étapes
La première étape décrit la désorption des supports de collecte.
Les désorbats des filtres imprégnés nécessitent un traitement particulier.
Deux traitements sont possible :
- soit le traitement sur résine H+
- soit l'ajout d'acide trifluoroacétique.
La deuxième étape décrit donc le traitement des solutions de désorption sur résine H+.
La troisième étape décrit le traitement à l'acide trifluoroacétique.
3 étapes de préparation :
Étape de préparation N°1
-
Solvant ou solution
- EAU OXYGENEE
- EAU
- ELUANT
-
Type de préparation
Désorption -
Volume
10 mL -
Ultrasons
- Temps d'ultrasons : 5 min
-
Autres conditions de préparation
- Après ouverture de la cassette, écarter les filtres membranes et déposer les filtres imprégnés utilisés au fond de béchers ou flacons (50 mL par exemple). Recouvrir chaque filtre de 5 à 20 mL d'eau (ou de l'éluant utilisé pour l'analyse chromatographique) et 200 µL d'H2O2.
- Soumettre les béchers (ou flacons) à agitation mécanique pendant environ 30 minutes ou aux ultrasons pendant 5 à 10 minutes.
- Les filtres membranes peuvent être utilisés pour le prélèvement et l'analyse des acides sulfurique, phosphorique et de leurs sels (voir schéma dans la partie Commentaires ci-dessous)
-
Commentaires
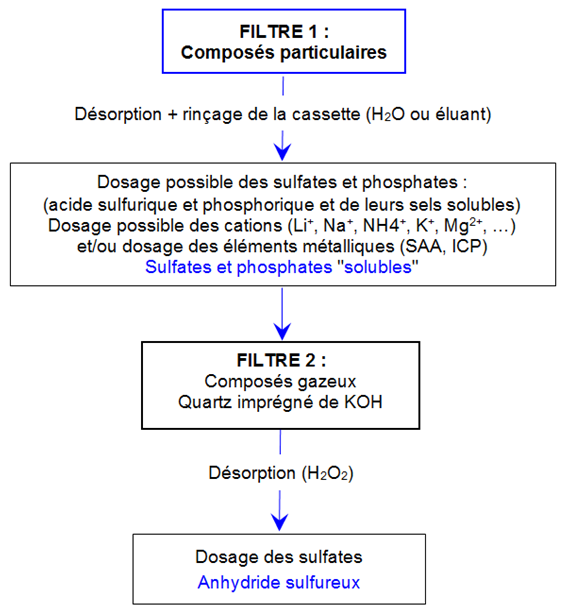
Étape de préparation N°2
-
Solvant ou solution
- EAU
-
Type de préparation
Percolation -
Volume
5 mL -
Autres conditions de préparation
Traitement sur résine H+
Première méthode
- Préparation de la résine H+
Juste avant l’analyse :
- préparer le montage n° 1 ou utiliser le dispositif d’extraction liquide/solide vendu dans le commerce,
- placer une ou de(s) cartouche(s) vide(s) munie(s) d’un fritté sur le dispositif,
- relier le dispositif à la trompe à eau,
- mettre en place la trompe à eau de façon à créer un vide modéré (5 à 7 cm Hg),
- rincer chaque cartouche avec de l’eau,
- verser dans chaque cartouche, au moyen d’une pipette automatique, 1,5 mL d’une solution aqueuse de résine échangeuse de cations soit environ 500 mg de résine,
- mettre en place un fritté, préalablement rincé avec de l’eau, à la partie supérieure de la cartouche ; tasser avec un agitateur en verre,
- placer sur la cartouche un adaptateur et une cartouche vide de 15 mL,
- rincer avec un grand volume d’eau (50 mL par exemple),
- sécher la résine après le dernier rinçage en appliquant un vide plus poussé.
La cartouche est prête à l’emploi.
montage 1
Préparation de la cartouche de résine H+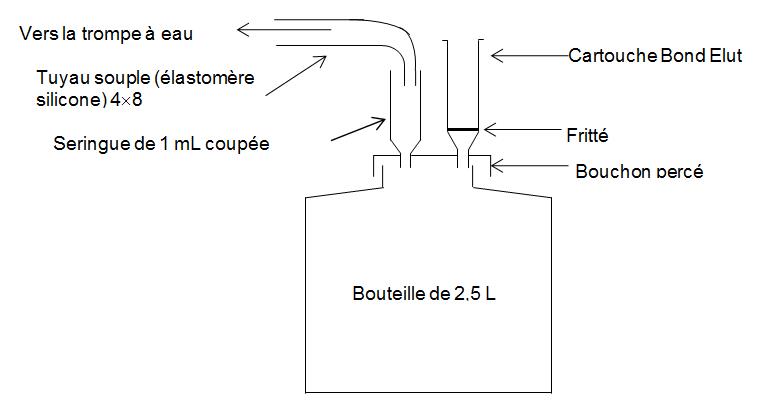
- Traitement de l’échantillon
Juste avant l’analyse :
- préparer le montage n° 2 ou un dispositif équivalent,
- prélever 5 mL de désorbat,
- le faire passer sur la résine goutte à goutte en réglant le débit de la trompe à eau,
- recueillir la solution à analyser dans un tube du passeur d’échantillon.
montage 2
Traitement des échantillons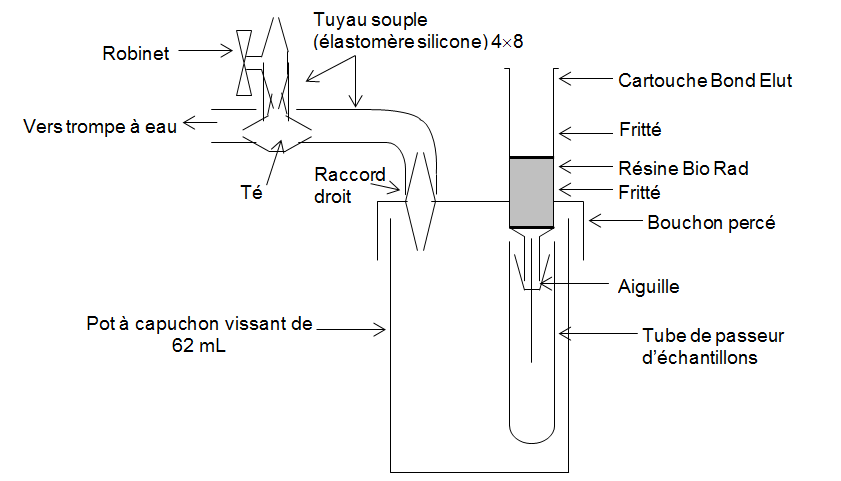
Deuxième méthode
- Lavage préalable de la résine :
- faire passer 2 L d’eau sur environ 10 g de résine placés sur un système de filtration sur fritté avec filtre de cellulose,
- sécher sous vide.
- Préparation de la suspension aqueuse de résine :
- la suspension est préparée avec un mélange 50/50 en masse d’eau et de résine fraîchement lavée,
- la suspension est maintenue en agitation par un barreau aimanté et prélevée à l’aide d’une micropipette à embout jetable.
- Traitement des désorbats des filtres imprégnés :
- prélever 2,5 mL de désorbat (décanté 1 à 2 heures afin d’éviter l’entraînement de particules solides),
- ajouter 1 mL de suspension de résine H+ dans l’eau.
Ce traitement correspond à un ajout de 0,5 mL d’eau (dont on tiendra compte soit en appliquant dans les calculs un facteur de dilution, soit en faisant subir le même traitement aux solutions d’étalonnage).
Étape de préparation N°3
-
Séparation des plages
oui -
Solvant ou solution
- ACIDE TRIFLUOROACETIQUE
-
Type de préparation
Concentration -
Autres conditions de préparation
Traitement à l’acide trifluoroacétique
- Mesurer le pH de la solution de désorption des filtres servant de blancs de laboratoire à l’aide d’une électrode combinée
de pH. - Compter le nombre de gouttes d’acide trifluoroacétique nécessaires pour ramener le pH entre 7 et 8.
- Ajouter ce même nombre de gouttes d’acide aux désorbats de filtres prélevés, aux blancs de terrain et de laboratoire et aux solutions d’étalonnage.
- Mesurer le pH de la solution de désorption des filtres servant de blancs de laboratoire à l’aide d’une électrode combinée
-
Commentaires
Se souvenir qu’au contact de l’eau l’acide trifluoroacétique forme de l’acide fluorhydrique. Lors de son utilisation prendre toutes les précautions décrites pour la manipulation d’acide fluorhydrique qui présente un danger spécifique important. En particulier, s’assurer de la présence à proximité de l’opérateur de gel au gluconate de calcium. En cas de contact accidentel, effectuer un rinçage abondant à l’eau et traiter immédiatement la peau avec du gel au gluconate de calcium avant l’apparition de la douleur.
Une condition analytique :
Condition analytique N°1
-
Technique analytique
- ELECTROPHORESE CAPILLAIRE
-
Injecteur
- PASSEUR AUTOMATIQUE
-
Colonne
- SPECIFIQUE
-
Détecteur
- ULTRAVIOLET (UV)
Étalonnage et expression des résultats
La méthode d'étalonnage indiquée est celle utilisée lors du développement. Elle n'a cependant pas de caractère obligatoire
-
Principe d'étalonnage
externe -
Solvant de l’étalon
- Même solvant que celui des échantillons
-
Commentaires
Réaliser des étalons à partir de substance de référence,commerciales ou synthétisées en laboratoire. Le solvant utlisé pour réaliser les solutions sera celui choisi pour le traitement des échantillons
Préparer une gamme d'étalonnage, dans la même matrice que les échantillons (ne pas oublier le filtre imprégné),
-
Calcul de la quantité de substance sur le dispositif
La concentration des échantillons est déterminée sur la courbe d’étalonnage.
La concentration du polluant dans l’atmosphère est donnée par :
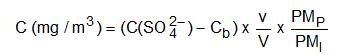
avec
C(SO42-) (mg/L) : concentration de l’ion dans l’échantillon Cb (mg/L) : moyenne des concentrations dans les blancs de laboratoire v (mL) : volume de reprise des échantillons PMP (g/mol) : masse moléculaire du polluant, ici SO2 (64 g/mol) PMI (g/mol) : masse moléculaire de l’ion, ici SO42- (96 g/mol) V (L) : volume d’air prélevé
Compléments
Un exemple de conditions d'analyse et d'électrophérogramme est mentionné dans les données de validation - compléments dans la fiche "Anions minéraux par électrophorèse capillaire"
Bibliographie
- T 90-042. Septembre 1988. - Essais des eaux. Dosage d’anions (Cl-; NO2-; NO3-; PO43-; SO42-; F-; Br-) par chromatographie ionique. Paris - La Défense, AFNOR, 1988, 15 p.
- M. HÉRY, V. LAMANT, B. OURY, A. PELTIER. - Méthodes de prélèvements d'aérosols d'acides, de bases et de sels. Cahiers de notes documentaires, 1987, 129, ND 1650, pp. 553-563.
- V. LAMANT, B. OURY. 6 Méthodes de prélèvements et d'analyses des aérosols d'acides, de bases et de sels. NS 75, Paris, INRS, janvier 1990.
- B.O. HALLBERG, J. RUDLING, A. HULTMAN, M. HULTENGREN. - A filter method for the active and passive monitoring of sulfur dioxide in workplace air. Scand. J. Work Environ. Health 10, 1984, pp. 305-309.
Historique
| Version | Date | Modification(s) faisant l’objet | Paragraphes |
|---|---|---|---|
| 008 | Jusqu’au | Création + mises à jour |
|
| 008/V01 | 25/01/2006 | Nouvelle présentation | Prélèvement |
| 008/V01.01 | 25/09/2012 | Révision de la terminologie (VLEP-8h, VLCT, Dispositif de prélèvement et support de collecte, eau ultra-pure, blanc de terrain et blanc de laboratoire) | Toute la fiche |
| M-155/V01 | Novembre 2015 | Mise en ligne Prélèvement sur cassette fermée Substance unique Analyse par électrophorèse capillaire | |
| M-155/V01.01 | Janvier 2018 | Ajout schéma | Préparation de l'analyse |
Date de mise à jour : janvier 2018
Ancien numéro de fiche MétroPol : 008
