Prélèvement : Actif sur cartouche de silice imprégnée ; cassette avec filtres imprégnés
Analyse : potentiométrie ; chromatographie ionique avec suppression détection conductimétrique
Données de validation : Validation complète
Substances
Informations générales
Propriétés physico-chimiques
| Nom | N° CAS | Formule chimique | Classification CMR |
|---|---|---|---|
| Trichlorure d'azote | 10025-85-1 | NCl3 |
|
Plus d'informations
| Nom | Masse molaire | Densité | Synonymes | Fiche toxicologique |
|---|---|---|---|---|
| Trichlorure d'azote | 120,36 |
Familles de substances
- CHLORAMINES
Principe et informations
Cette méthode permet la détermination de façon indépendante du trichlorure d’azote, du chlore et autres dérivés chlorés (résultats exprimés en équivalent chlore Cl2).
Cette méthode permet de doser les dérivés du chlore (acide hypochloreux, hypochlorite, chloramines…) présents dans l’atmosphère des halls de piscine par exemple ou de tout autre lieu utilisant des composés chlorés pour la désinfection des eaux (agro-alimentaire…). La formation respective des différentes chloramines dépend du pH et du rapport chlore/azote.
Le gel de silice retient les composés chlorés (chlore, acide hypochloreux, monochloramine et dichloramine) avec une efficacité supérieure à 95 %. La réaction est une réaction du type :
Exemple de l’acide hypochloreux
NH2SO3H + HOCl → ClNHSO3H + H2O
Les filtres imprégnés collectent la fraction de chloramines la plus volatile (trichlorure d’azote NCl3) avec une efficacité proche des 100 %. Le principe est basé sur la décomposition à pH élevé, grâce au carbonate de sodium, du NCl3 en ammoniac et hypochlorite. L’hypochlorite formé est ensuite réduit en chlorures par le trioxyde de diarsenic, selon les réactions :
2 NCl3 + 6 H2O → 2 NH3 + 6 HOCl
3 As2O3 + 6 HOCl → 3 As2O5 + 6 HCl
Pour les prélèvements dans les atmosphères de halls de piscines par exemple où le trichlorure d’azote peut représenter 95% des espèces chlorées présentes, une cassette seule peut être utilisée.
L’utilisation d’une cassette seule permet également la détermination de tous les composés chlorés sans distinction.
Pour déterminer la teneur en chloramines et dérivés chlorés sans distinction, les prélèvements sont effectués uniquement avec une cassette contenant un filtre membrane, placé avant le premier filtre imprégné, en PVC ou PTFE par exemple (pour la pollution particulaire) et les trois filtres imprégnés (pour la pollution gazeuse), le dernier servant à objectiver un éventuel claquage.
Précautions particulières :
- Le trioxyde de diarsenic est un composé très toxique par ingestion, inhalation et contact cutané. Toutes précautions devront être prises lors de sa manipulation et son élimination pour limiter l’exposition au plus bas niveau possible.
- La manipulation des supports de collecte à toutes les étapes, de l'imprégnation à l'extraction, doit être réalisée avec un maximum de précautions, avec utilisation de gants, pinces et sous sorbonne, pour éviter toute pollution.
Principe de prélèvement et d'analyse
-
État physique
Aérosols (mélange de gaz ou vapeurs / particules) -
Type de prélèvements
Actif -
Nom du dispositif
cartouche de silice imprégnée ; cassette avec filtres imprégnés -
Plus d'informations
-
Technique analytique
POTENTIOMETRIE;CHROMATOGRAPHIE IONIQUE AVEC MEMBRANE DE SUPPRESSION -
Injecteur
PASSEUR AUTOMATIQUE -
Détecteur
ELECTRODE SPECIFIQUE;CONDUCTIMETRIE
Domaine d'application
| Substance | Quantité minimum sur le dispositif | Quantité maximum sur le dispositif | Concentration minimum | Concentration maximum | Volume maximum |
|---|---|---|---|---|---|
| Trichlorure d'azote | 13 µg |
450 µg |
0,03 mg/m3 |
1,05 mg/m3 |
480 L |
Réactifs
- ACETATE DE SODIUM
- ACIDE ACETIQUE
- ACIDE SULFAMIQUE
- CARBONATE DE SODIUM
- EAU
- GLYCEROL
- IODATE DE POTASSIUM
- IODURE DE POTASSIUM
- SOLUTION ETALON 1g/L
- TRIOXYDE DE DIARSENIC
Méthode de prélèvement
Deux dispositifs de prélèvement (en série) :
Dispositif N°1
-
Type dispositif
CARTOUCHE -
Support ou substrat de collecte
- GEL DE SILICE IMPREGNE
-
Quantité de support dans la plage de mesure (mg)
1000 -
Quantité de support dans la plage de garde (mg)
500 -
Préparation du substrat
100 g de gel de silice sont lavés à l'eau ultra-pure et séchés à 60°C. Ensuite ils sont mélangés à 200 mL de solution acide sulfamique à 25 g/L et séchés à 60°C.
-
Perte de charge du dispositif au débit de prélèvement
2,5 kPa -
Commentaires, conseils et consignes
Les deux plages sont séparées par un fritté 20 µm.
Dispositif N°2
-
Type dispositif
CASSETTE 37 mm 4 pièces -
Support ou substrat de collecte
- 3 FILTRES EN FIBRE DE QUARTZ IMPREGNES
-
Préparation du substrat
- Préparation de la solution d'imprégnation :
- Solubiliser 8 g de carbonate de sodium dans de l'eau ultrapure. Ajouter 0,8 g de trioxyde de diarsenic et passer la solution 1 heure aux ultrasons puis sous agitation minimum 24h. Cette étape permet une meilleure solubilisation de As2O3. La présence d'un léger trouble ou de petites particules non solubilisées peut subsister, le réactif étant en excès. Ajouter 4 mL de glycérol et compléter à 100 mL avec de l'eau ultra pure.
Cette solution peut être conservée jusqu'à 1 an dans un local exempt de toute pollution.
- Imprégnation des filtres :
- Les filtres sont imprégnés avec 500 µL de solution d'imprégnation.
Le séchage est réalisé sous sorbonne pendant 24 h dans un local exempt de toute pollution. Les cassettes sont ensuite fermées et conservées dans ce local jusqu’à leur utilisation.
-
Perte de charge du dispositif au débit de prélèvement
0,75 kPa -
Commentaires, conseils et consignes
Les 3 filtres imprégnés sont répartis comme suit :
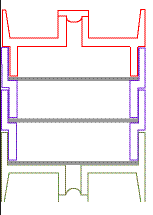
Note : Les 2 premiers filtres imprégnés sont désorbés ensemble. Le troisième filtre est désorbé seul pour objectiver un éventuel claquage (voir essais réalisés en piscine dans les données de validation).
Schéma du dispositif en série
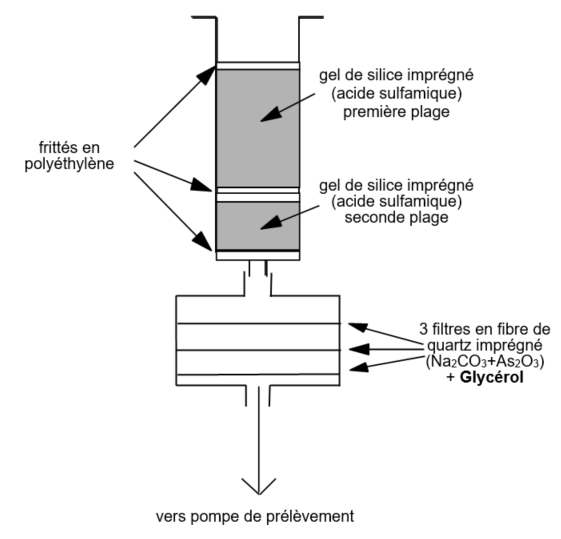
Note : Les 2 premiers filtres imprégnés sont désorbés ensemble. Le troisième filtre est désorbé seul pour objectiver un éventuel claquage.
Perte de charge du dispositif en série : 3,16 kPa
Utilisation de la cassette seule :
La cassette seule peut être utilisée dans les piscines par exemple où le trichlorure d'azote peut représenter 95% des espèces chlorés. Pour déterminer la teneur en chloramines et dérivés chlorés sans distinction, les prélèvements sont effectués uniquement avec une cassette contenant un filtre membrane, placé avant le premier filtre imprégné, en PVC ou PTFE par exemple (pour la pollution particulaire) et trois filtres imprégnés (pour la pollution gazeuse).
Les filtres imprégnés sont répartis comme suit :
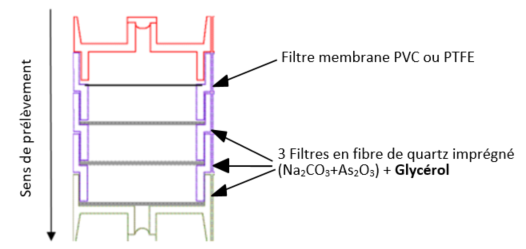
Notes :
- Les 2 premiers filtres imprégnés sont désorbés ensemble. Le troisième filtre est désorbé seul pour objectiver un éventuel claquage (voir essais réalisés en piscine dans les données de validation).
- La désorption et l'analyse du filtre membrane seront réalisées séparément des filtres imprégnés et uniquement si l'on souhaite doser les composés chlorés sous forme de sels (ce filtre membrane ne retient pas le trichlorure d'azote gazeux), mais ces résultats ne doivent pas être ajoutés aux résultats obtenus pour les filtres imprégnés qui captent les composés gazeux.
Conditions de prélèvement
-
Débit de prélèvement (L/min)
1 -
15 minutes (VLEP-CT possible dans ces conditions)
oui -
Temps de prélèvement maximum en heures
8
Pompe de prélèvement
- Pompe à débit de 0,1 à 3,5 L/min
Conditionnement particulier
-
Choix conditionnement particulier
Désorption immédiate -
Description
Les tubes devront être désorbés le jour du prélèvement. Après les prélèvements, les plages de gel de silice sont désorbées séparément dans 10 mL de solution d’acide sulfamique à 1 g/L.
Si les prélèvements sont effectués dans des piscines, éviter l’utilisation de récipients en verre.
Compléments
- Contrôler régulièrement la pompe pour éviter les problèmes de perte de charge.
Préparation des dispositifs de prélèvement en vue d’une intervention en entreprise
Méthode d'analyse
Principe général de l'analyse en laboratoire
Préparation d'analyse
-
Conditions de conservation avant analyse
- Avant prélèvement :
La durée de conservation des filtres vierges imprégnés est fixée à 6 mois. L'absence d'interférent peut être vérifiée en traitant quelques filtres selon la méthode d'analyse habituellement utilisée au laboratoire.
Les tubes de gel de silice imprégné peuvent être conservés également 6 mois (sous réserve de vérification du potentiel oxydant du gel en réalisant une mesure du gel de silice dans l'acide sulfamique par potentiomètrie (pollution possible lors du stockage)).
- Après prélèvement :
Les tubes devront être désorbés le jour du prélèvement et analysés dans les 10 jours.
Les cassettes pourront être conservées 30 jours sans perte de polluant.
-
Séparation des dispositifs
oui -
Séparation des plages
oui -
Nombre d'étapes de préparation
2 -
Commentaires sur les étapes
La première étape décrit le traitement des tubes. Les solutions seront dosées par potentiométrie.
La deuxième étape décrit le traitement des cassettes. Les solutions d'extraction seront dosées par chromatographie ionique.
-
Conditions de conservation échantillon préparé avant analyse
Les solutions de désorption des cassettes se conservent à température ambiante pendant 30 jours.
2 étapes de préparation :
Étape de préparation N°1
-
Séparation des plages
oui -
Solvant ou solution
- ACIDE SULFAMIQUE
-
Type de préparation
Désorption -
Volume
10 mL -
Autres conditions de préparation
- Après prélèvement, les plages de gel de silice sont désorbées séparément dans 10 mL de solution d’acide sulfamique à 1 g/L.
- Ajouter 0,1 mL de solution d’iodure de potassium (KI) 0,5 M.
- Laisser agir pendant environ 2 minutes.
- Ajouter ensuite 1 mL de solution tampon pH = 4,5 (acétate de sodium 1,8 M, acide acétique 6,4 M).
- Les solutions obtenues sont ensuite dosées par potentiométrie.
- Effectuer les mesures potentiométriques dans les 30 minutes suivant l’ajout du tampon.
-
Commentaires
Remarque
Traiter les blancs de laboratoire et blancs de terrain de la même façon.
Étape de préparation N°2
-
Séparation des plages
oui -
Solvant ou solution
- EAU
- ELUANT
-
Type de préparation
Extraction -
Volume
20 mL -
Ultrasons
- Temps d'ultrasons : 10 min
-
Autres conditions de préparation
- Ouvrir la cassette pour récupérer chaque filtre imprégné.
- Déposer les deux premiers filtres imprégnés dans un flacon. Le dernier filtre est placé seul dans un autre flacon pour évaluer un éventuel claquage lors du prélèvement.
- Introduire 20 mL de solution adaptée (eau ou éluant) dans le flacon avec les 2 filtres et 10 mL pour le filtre seul.
- Soumettre les flacons aux ultrasons pendant 10 minutes (ou agitation mécanique pendant 30 minutes).
Remarque : Traiter les blancs de laboratoire et les blancs de terrain de la même façon.
-
Filtration
Les solutions obtenues sont ensuite filtrées avant analyse.
Description
Analyse de la fraction particulaire uniquement si utilisation de la cassette seule et pour le dosage des composés chlorés sous forme de sels, le trichlorure d'azote n'est pas retenu sur ce filtre.
Deux conditions analytiques :
Condition analytique N°1
Les conditions analytiques utilisées lors du développement de la méthode sont fournies avec les données de validation 2.
-
Technique analytique
- POTENTIOMETRIE
-
Détecteur
- ELECTRODE SPECIFIQUE
-
Commentaires, conseils ou condition particulières
Analyse par potentiométrie
Les réactions mises en jeu en milieu acide et en présence d'iodure de potassium sont les suivantes :
IO3- + 5 I- + 3 H2O → 3 I2 + 6 OH- (1) pour les étalons Cl2 + 2 I- → 2 Cl- + I2 (2) pour les tubes désorbés (1) : n moles de IO3- + 5n moles de I- (provenant du KI) libèrent 3n moles de I2.
(2) : l'iodure réagit complètement avec le chlore pour former de l'iode, n moles de Cl2 donnent
n moles de I2.La méthode consiste à mesurer l'iode libéré par potentiométrie à l'électrode spécifique chlore résiduel.
D’après (1) et (2), n moles Cl2 (présentes dans les solutions désorbées) équivalent à (n/3) moles IO3- (étalons), comme :
masse molaire M(Cl2) = 71 g/mol,
masse molaire M(KIO3) = 214 g/mol,
Une quantité m (exprimée en mg/L) de KIO3 donne la même réponse potentiométrique que la même quantité m (en mg/L) de Cl2. L’étalonnage effectué à l’aide de KIO3 permet donc d’établir une courbe d’étalonnage directement exprimée en Cl2.
Condition analytique N°2
-
Technique analytique
- CHROMATOGRAPHIE IONIQUE AVEC MEMBRANE DE SUPPRESSION
-
Injecteur
- PASSEUR AUTOMATIQUE
-
Colonne
- COLONNE A SUPPRESSION
- ECHANGEUSE D'IONS
-
Détecteur
- CONDUCTIMETRIE
-
Commentaires, conseils ou condition particulières
Autres méthodes utilisables pour le dosage des solutions de désorption des filtres :
Chromatographie ionique sans suppression, détection conductimétrique ou électrophorèse capillaire (Voir les méthodes d'analyse des Anions minéraux).
Étalonnage et expression des résultats
La méthode d'étalonnage indiquée est celle utilisée lors du développement. Elle n'a cependant pas de caractère obligatoire
-
Principe d'étalonnage
externe -
Solvant de l’étalon
- Même solvant que celui des échantillons
-
Commentaires
Tubes de gel de silice par potentiométrie :
L’étalonnage effectué à l’aide de KIO3 permet d’établir une courbe d’étalonnage directement exprimée en Cl2.
- Préparer une solution-mère à 1 g/L de KIO3 dans l’acide sulfamique (soit 0,1 g de KIO3 dans 100 mL d’acide sulfamique à 1 g/L). Les solutions étalon de KIO3 doivent être préparées le jour de l'analyse.
- Préparer une solution à 100 mg/L de KIO3 par dilution de cette solution-mère au 1/10 (10 mL/100 mL d’eau).
- Préparer une gamme d’étalonnage (par exemple de 1 à 20 mg/L en KIO3) par dilutions de la solution à 100 mg/L (par exemple 0,1- 0,5- 1- 1,5 et 2 mL dans 10 mL d’acide sulfamique (1 g/L)).
- Ajouter dans chacun des étalons une mesure de gel de silice imprégné, équivalent à la quantité dans un tube, puis 0,1 mL de KI (0,5 M), agiter et, 2 minutes plus tard, 1 mL de solution tampon pH 4,5.
- Effectuer les mesures potentiométriques dans les 30 minutes suivant l’ajout du tampon.
Filtres imprégnés par chromatographie :
Les réactions d’oxydo-réduction mises en jeu en milieu alcalin sur les filtres imprégnés (décrite dans le principe) montre que la méthode consiste en final à doser les chlorures.
Une gamme d’étalons est préparée, dans la même matrice, par dilution dans de l’eau, de la solution étalon de chlorure à 1 g/L.
-
Calcul de la quantité de substance sur le dispositif
Cas des tubes de gel de silice : potentiométrie
- La concentration C exprimée en équivalent-chlore sera :
- soit calculée à partir de la formule donnée sur le manuel d'instructions fourni avec les électrodes utilisées,
- soit déterminée sur une courbe d'étalonnage E = f (log C) établie à l'aide des solutions étalon.
- La concentration, dans l'atmosphère, en composés dérivés du chlore (autres que NCl3) est donnée par :
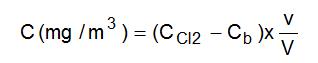
avec :
CCl2 (mg/L) concentration de l'échantillon en équivalent-chlore Cb (mg/L) concentration moyenne des blancs de laboratoire en équivalent-chlore V (L) volume d'air prélevé v (mL) volume de reprise des échantillons Cas des filtres : analyse chromatographique
- La concentration des échantillons est déterminée sur la courbe d’étalonnage.
- La concentration du polluant dans l’atmosphère, exprimée en NCl3, est donnée par :
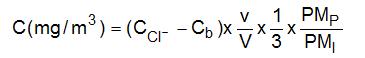
avec :
CCl- (mg/L) concentration de l’ion Cl- dans l’échantillon Cb (mg/L) concentration moyenne de l'ion Cl- dans les blancs de laboratoire v (mL) volume de reprise des échantillons PMP (g/mol) masse molaire du polluant, ici trichlorure d’azote (120,5 g/mol) PMI (g/mol) masse molaire de l’ion, ici Cl- (35,5 g/mol) V (L) volume d’air prélevé 1/3 rapport entre le nombre de moles Cl- dosées et le nombre de moles NCl3 effectivement présentes sur les filtres
Bibliographie
[1] Chlorine in Workplace Atmospheres. Method ID-101, in OSHA Analytical Methods Manual, 1981, 23 p.
[2] BARBEE S.J., THACKARA J.W. and RINEHART W.E. - Acute inhalation toxicology of nitrogen trichloride. Am. Ind. Hyg. Ass. J. 44, 1983, pp. 145-146.
[3] GAGNAIRE F., AZIM S., BONNET P., HECHT G. and HERY M. - Comparison of the sensory irritation response in mice to chlorine and nitrogen trichlorideJ. Appl. Toxicol. 14, 1994, pp. 405-409.
[4] HAILIN G.E., WALLACE G.G. and O’HALLORAN R.A.J. - Determination of trace amounts of chloramines by liquid chromatographic separation and amperometric detection. Analyt. Chim. Acta. 237, 1990, pp. 149-153.
[5] HERY M., HECHT G., GERBER J.M., GENDRE J.C., HUBERT G., REBUFFAUD J. - Exposure to chloramines in the atmosphere of indoor swimming pools. Ann. Occup. Hyg. 39, 1995, pp. 427-439.
[6] Henry’s law constants for flashoff. HOLZWARTH G., BALMER R.G. and SONY L. - The fate of chlorine and chloramines in cooling towers. Water Res. 18, 1984, pp.1421-1427.
[7] MASSIN N., BOHADANA A., WILD P., HERY M., TOAMAIN J.P. and HUBERT G. - Respiratory symptoms and bronchial responsiveness in lifeguards exposed to nitrogen trichloride in indoor swimming pools. Occupational and Environmental Medicine, 55, 1998, pp. 258-263.
[8] SANDERSON W.T., WEBER A. and ECHT A. - Case reports : epidemic eye and upper respiratory irritation in poultry processing plants. Appl. Occup. Environ. Hyg. 10, 1995, pp. 43-49.
[9] HERY M., HECHT G., GERBER J.M. et coll. - Exposition aux chloramines dans les atmosphères des halls de piscine. Cahiers de notes documentaires, 1994, 156, ND 1963, pp. 285-292.
[10] HERY M., GERBER J.M., HECHT G., SUBRA I., POSSOZ C., AUBERT S., DIEUDONNE M., ANDRE J.C. - Exposure to chloramines in a green salad processing plant. Annals of Occupational Hygiene, vol. 42, 1998, n° 7, pp. 437-45I.
[11] GERARDIN F., SUBRA I. - Mise au point d'une méthode de prélèvement et d'analyse du trichlorure d'azote en phase gazeuse. Cahiers de notes documentaires, 2004, 194, ND 2205-194-04, pp 39-50.
Historique
| Version | Date | Modification(s) faisant l’objet | Paragraphes |
|---|---|---|---|
| 007 | Jusqu’au | Création + mises à jour |
|
| 007/V01 | 25/01/2006 | Nouvelle présentation |
|
| 007/V01.01 | 17/10/ 2007 | Référence bibliographique [3] | Substances mesurables Annexe 2 |
| 007/V01.02 | 2013 | Principe de prélèvement (équations chimiques) Modification des schémas Révision de la terminologie | Principe Annexe 1 Toute la fiche |
| M-104/V01 | Novembre 2015 | Mise en ligne Prélèvement sur cassette + tube Analyse par potentiométrie + chromatographie ionique ou électrophorèse capillaire | |
| M-104/V01 | Juillet 2017 | Notation M-178 erronée corrigée par M-104 | Historique |
| M-104/V01 | Novembre 2017 | Correction porosité membrane PVC | Prinicpe et informations, Méthode de prélèvement |
| M-104/V01.01 | Juillet 2019 | Modification éditoriale sans impact sur le contenu de la méthode | |
| M-104/V02 | Mars 2021 | Modification imprégnation des filtres avec ajout de glycérol Ajout des données de validation pour le trichlorure d'azote sur cassette | Dispositif de prélèvement Données de validation |
| M-104/V02
| Octobre 2021
| Ajout précision pour l'utilisation de la cassette seule Ajout du tableau de calcul d'incertitude | Dispositif de prélèvement Données de validation |
| M-104/V03 | Septembre 2023 | Ajout d'un troisième filtre imprégné dans la cassette Modification de l'extraction des filtres imprégnés Ajout de données complémentaires dans les données de validations | Dispositif de prélèvement Préparation de l'analyse Données de validation |
Date de mise à jour : septembre 2023
Ancien numéro de fiche MétroPol : 007
