Pathologie - Toxicologie
-
Toxicocinétique - Métabolisme [15, 16, 17]
Le dichlorométhane est absorbé par voies respiratoire, orale et cutanée. Une partie du produit ayant pénétré dans l'organisme est éliminée sous forme inchangée par le poumon. Le reste subit un métabolisme qui conduit à deux produits terminaux : l'oxyde de carbone (oxydation en présence des cytochromes P450) et le dioxyde de carbone (voie de conjugaison avec le glutathion), éliminés dans l’air exhalé.
Chez l'animal
Absorption
Le dichlorométhane est rapidement absorbé par les alvéoles pulmonaires. Après exposition par inhalation (100 à 8000 ppm), chez le chien et le rat, l'absorption est proportionnelle à l'intensité et à la durée de l'exposition ; le rapport des concentrations sang/air augmente avec la concentration d'exposition, probablement par saturation du métabolisme.
Après exposition par voie orale chez le rat et la souris, l'absorption de dichlorométhane en solution aqueuse est rapide et importante (97 % en 24 heures) ; en solution hydrophobe (huile de maïs), le processus est ralenti (40 - 45 % de la dose en 2 heures) [18, 19].
Après exposition cutanée chez le rat, les données sont limitées ; des expériences menées in vitro sur la peau de rat ont permis de déterminer un flux percutané de 6,6 mg/cm²/h pour le dichlorométhane liquide [20].
Distribution
Après inhalation ou absorption par voie orale, le dichlorométhane se distribue largement dans les tissus de l'animal tels que les tissus adipeux, le foie, les reins, les poumons, le cerveau…. Il ne s'accumule pas : le dichlorométhane est éliminé du tissu adipeux dans les deux heures suivant l'exposition et plus lentement dans le reste de l'organisme [21].
Il traverse la barrière placentaire et peut être dosé dans le sang du fœtus, à un niveau cependant plus faible que celui du sang maternel.
Métabolisme
Le métabolisme chez l'animal est semblable à celui de l'Homme, pour des expositions faibles (différence des conditions de saturation des voies métaboliques (cf. figure 1)) :
-
par l'intermédiaire des mono oxydases à cytochrome P450 (CYP2E1), saturables entre 500 et 1000 ppm. Après saturation, les concentrations sanguines de dichlorométhane augmentent, en relation avec l'exposition;
- la voie de la glutathion-S-transférase qui mène au dioxyde de carbone. Elle est plus active chez la souris que chez le rat et moins active chez le hamster et l'homme.
Schéma métabolique
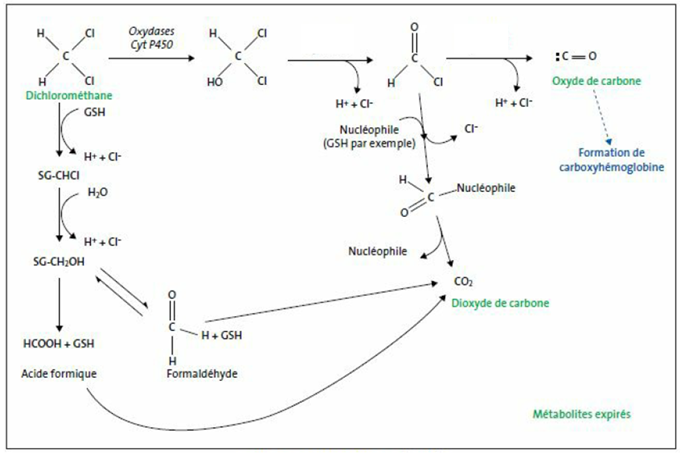
Fig. 1 : Métabolisme du dichlorométhane [22, 15, 16]
Excrétion
La vitesse d'élimination tissulaire du dichlorométhane est différente selon les espèces : chez le rat, il est éliminé en environ 8 heures, alors que chez la souris, il est éliminé en 2 heures.
Chez le rat, le dichlorométhane et ses métabolites sont excrétés majoritairement dans l'air expiré (58 - 71 - 79 % de la dose absorbée après exposition à 50 - 500 - 1500 ppm respectivement), essentiellement sous forme d'oxyde et de dioxyde de carbone et sous forme inchangée (respectivement 5 – 30 et 55 %).
De faibles quantités apparaissent dans l'urine, les fèces et le lait maternel.
Après administration par voie orale (1 ou 50 mg/kg), le rat excrète 78 ou 90 % de la dose absorbée dans l'air expiré. L'urine contient 2 ou 5 % de la dose absorbée et les fèces moins de 1 %.
Surveillance Biologique de l'exposition
Étant donné la bonne pénétration cutanée du dichlorométhane, la mise en place d'une surveillance biologique est particulièrement intéressante.
Le dosage du dichlorométhane urinaire en fin d’exposition ou fin de poste de travail, indicateur spécifique et bien corrélé avec les concentrations atmosphériques, est à privilégier pour la surveillance biologique de l’exposition au dichlorométhane.
Le dosage de la carboxyhémoglobine (HbCO) sanguine immédiatement en fin de poste de travail, permet d'apprécier l'importance de l'exposition du jour même. Très influencé par le tabagisme, il ne peut pas servir d'indicateur biologique d'exposition au dichlorométhane chez les fumeurs.
Pour ces deux indicateurs, des valeurs limites biologiques (VLB) basées sur une exposition à la VLEP-8 heures de 50 ppm ainsi que des valeurs biologiques de référence (VBR) à partir de données issues de populations non professionnellement exposées, sont proposées par l’Anses [32].
Le dosage du dichlorométhane sur sang total immédiatement en fin de poste de travail, témoin de l'exposition de l'heure précédente, peut également être proposé pour la surveillance biologique de l’exposition au dichlorométhane. Il ne présente cependant pas d’avantage par rapport au dosage urinaire de dichlorométhane : demi-vie très courte et moins bonne corrélation avec les concentrations atmosphériques. Des valeurs biologiques d’interprétation (VBI) pour le milieu professionnel sont proposées pour cet indicateur par des organismes autres que l’Anses [33].
Toxicité expérimentaleToxicité aiguë [16, 22]
Le dichlorométhane agit essentiellement sur le système nerveux central, le foie et les poumons ; il est modérément irritant pour la peau et les yeux de lapins.
La toxicité aiguë du dichlorométhane est faible (tableau I). Par voie orale, la DL50 est de 1990 mg/kg chez la souris ; chez le rat, elles sont comprises entre 1400 et 2500 mg/kg [15]. Par inhalation, les CL50 (6 heures) varient de 11380 ppm (40200 mg/m3) à 15810 ppm (55900 mg/m3) chez le cochon d’Inde, le rat et la souris. Par voie cutanée, aucune mortalité n’est observée chez des rats exposés à 2000 mg/kg pc pendant 24 heures [4]. À forte dose ou concentration, les animaux meurent essentiellement par arrêt respiratoire suite à une dépression du système nerveux central.
Chez le rat, l’administration de 530 mg/kg ou plus de dichlorométhane entraine l’apparition de troubles musculo-squelettiques, d’hypotension, d’hypothermie et une congestion du tractus gastro-intestinal avec microhémorragies [15]. A fortes doses, des effets hépatiques et neurologiques sont rapportés :
- diminution du contenu en cytochrome P450 dans les microsomes hépatiques (rats, 1000 mg/kg), signes de nécrose hépatique, augmentation de l’activité de la glucose-6-phosphatase (rats mâles, 2210 mg/kg) et augmentation des taux de triglycérides hépatiques (souris mâles, 2700 mg/kg) ;
- dépression du système nerveux central.
Les effets narcotiques, caractérisés notamment par une baisse d'activité, une mauvaise coordination motrice et une somnolence, sont observés à partir de 4900 ppm (17700 mg/m3 pendant 1,5 h) chez le rat ; de légers changements dans les électroencéphalogrammes sont rapportés dès 500 ppm chez le rat (1770 mg/m3 pendant 3 h).
Des effets pulmonaires (vacuolisation des cellules de Clara) sont notés chez la souris (≥ 2000 ppm, 6 heures), mais pas chez le rat.
Des modifications hépatiques sont induites par le dichlorométhane inhalé : dégénérescence graisseuse du foie et augmentation des enzymes plasmatiques (souris, inhalation 4900 ppm pendant 1,5 h) et des triglycérides hépatiques (cobaye, 5200 ppm, 6 heures). Ces effets sont réversibles à l'arrêt de l'exposition [17].
Voie
Espèce
DL50/CL50
Inhalation
Rat
57000 ppm/15mn
54000 mg/m3/6h (16450 ppm)
Cobaye
40300 mg/m3/6h (11600 ppm)
Souris
51000 mg/m3/8h (16189 ppm)
Orale
Rat
2100-2300 mg/kg (dans l’huile)
2388 mg/kg
Souris
1987 mg/kg
Tableau I. Toxicité aiguë du dichlorométhane
Irritation, sensibilisation [15]
Chez le lapin, le dichlorométhane (0,01 - 0,1 ml) provoque une irritation et une inflammation oculaires modérées, un épaississement de la cornée et une augmentation de la tension intraoculaire ; les effets sont réversibles en 3 à 9 jours. L'exposition aux vapeurs (≥ 490 ppm, 10 minutes) provoque des modifications oculaires identiques, mais plus légères et réversibles en 2 jours [16].
L'application de 0,5 ml de dichlorométhane sur la peau de lapin pendant 4 heures, sous pansement occlusif, induit une irritation modérée, sans aucun effet corrosif.
Un essai de stimulation locale des ganglions lymphatiques chez la souris donne un résultat négatif [4].
Toxicité subchronique, chronique [25, 16]
En exposition prolongée, le dichlorométhane induit une dépression du système nerveux central ; il provoque également des effets sur le foie, les reins et le tractus respiratoire, ainsi qu'une augmentation du taux sanguin de carboxyhémoglobine.
Comme en exposition aiguë, le dichlorométhane, en exposition prolongée à forte concentration (10000 ppm, rat, 7 h/j, 6 mois) [15], agit sur le système nerveux central (narcose, inactivité après excitation initiale) ; cependant, une exposition à 2000 ppm durant 13 semaines n'a pas modifié les potentiels sensoriels évoqués, les réflexes, le comportement ou les déplacements du rat.
L'exposition au dichlorométhane provoque une augmentation du taux sanguin de carboxyhémoglobine chez le chien et le singe (100 ppm pendant 100 jours), et le rat (200 ppm pendant 2 ans), sans modification d'autres paramètres hématologiques ou de chimie clinique [15].
Un effet hépatique (dégénérescence graisseuse centrolobulaire modérée, hémosidérose, hépatomégalie, nécrose) a été montré chez le rat et le cobaye (5000 ppm, 7 h/j, 5j/sem, pendant 6 mois ou 1000 ppm pendant 2 ans), la souris (4000 ppm, 6 h/j, 5 j/sem, 102 semaines) et le chien (10 000 ppm, 7 h/j, 5 j/sem, 6 mois) qui présente également un rétrécissement des voies biliaires [15, 34]. À des concentrations plus faibles (25 et 100 ppm durant 14 semaines, en continu), aucun effet hépatique n'est observé chez le singe et le chien, la souris présente des modifications graisseuses à 100 ppm, le rat est le plus sensible avec des effets hépatiques (vacuolisation cytoplasmique, infiltration graisseuse) observés dès 25 ppm [20].
L'inhalation pendant 2 ans de dichlorométhane a induit une augmentation de l'incidence d'anomalies des tubules rénaux chez des rats femelles à partir de 1000 ppm et chez les souris des deux sexes à partir de 2000 ppm[34].
Le système respiratoire est également un organe cible du dichlorométhane inhalé. Des cas de pneumonie ont été observés chez le cobaye exposé à 5000 ppm jusqu'à 6 mois (chez 3 animaux sur 14 ; 7 h/j, 5 j/sem [15]), et une inflammation pulmonaire a été mise en évidence chez le rat, exposé à 3600 ppm (5 h/j, 5 j/sem, 4 sem) [35]. Une métaplasie squameuse des muqueuses des cavités nasales a été notée chez des rates exposées à 1000 ppm pendant 2 ans [34].
Par voie orale, le dichlorométhane occasionne des effets hépatotoxiques chez l'animal : nécrose centrolobulaire, vacuolisation hépatocytaire et accumulation de pigments lipidiques à partir de 420 mg/kg pc/j chez les rats mâles et 607 mg/kg pc/j chez les femelles (90 jours, dans l’eau de boisson). Dans les mêmes conditions, les effets hépatiques sont moins marqués chez la souris, avec de légères modifications graisseuses centrolubulaires à partir de 587 mg/kg pc/j [16]. Des effets sanguins (augmentation du nombre de globules rouges, de l'hématocrite et de l'hémoglobine) ont été provoqués par une exposition du rat à 55 - 249 mg/kg/j dans l'eau de boisson pendant 2 ans ; aucun effet n'a été noté chez la souris [36, 37].
Effets génotoxiques [38]
Le dichlorométhane est mutagène in vitro. In vivo, il présente une spécificité d'espèce (résultats positifs que chez la souris) et de tissu suggérant une influence du métabolisme sur la génotoxicité.
In vitro, le dichlorométhane induit :
- des mutations géniques, avec ou sans activateurs métaboliques, chez les bactéries (Salmonella typhimurium TA98, TA100, Escherichia coli, protocole vapeur) ;
- des aberrations chromosomiques (avec ou sans activation métabolique) et des échanges entre chromatides sœurs (avec ou sans activation métabolique) dans les cellules ovariennes de hamster chinois, les cellules de lymphome de souris et les lymphocytes périphériques humains ;
- une transformation cellulaire dans les cellules embryonnaires de hamster chinois.
In vivo, il provoque :
- des cassures de l'ADN dans le foie et le poumon de la souris (oral, 1720 mg/kg) et le foie du rat (oral, 1275 mg/kg), mais pas de synthèse non programmée ni d'alkylation de l'ADN après exposition orale ou par inhalation ;
- des aberrations chromosomiques (cellules pulmonaires et de la moelle osseuse de souris), des échanges entre chromatides sœurs (lymphocytes périphériques et cellules pulmonaires de souris) après inhalation de fortes concentrations (≥ 4000 ppm, 6 h/j, 5 j/sem, 10 jours) et des micronoyaux dans les érythrocytes périphériques de la souris (2000 ppm, 6 h/j, 5 j/sem, 12 semaines), mais ni par d'autres voies (voie orale ou i.p.) ni chez le rat (inhalation, 1600 ppm, 6 h/j, 5 j/sem, 6 sem).
Il n'occasionne ni létalité dominante chez la souris (sc. 5 ml/kg, 3 fois/sem, 4 semaines ou inhalation 0-100-150-200 ppm, 2 h/j, 5 j/sem, 6 semaines) [39] ni létalité liée au sexe chez la drosophile (inhalation, 4000 ppm, 6 h, 1 semaine ou 2 semaines).
Effets cancérogènes [38]
L'action cancérogène du dichlorométhane chez l'animal, en fonction de l'espèce (la souris étant la plus sensible), est liée à son métabolisme, et particulièrement à la voie du glutathion.
L'effet cancérogène du dichlorométhane a été testé par inhalation :
- chez le rat exposé à de faibles concentrations (60 ou 100 ppm, 7 h/j, 5 j/sem pendant 2 ans), aucune augmentation significative de l'incidence totale des tumeurs n’est observée [40]. Quand la concentration augmente (500 - 1500 - 3 500 ppm ou 1000 - 2000 - 4000 ppm, 6 h/j, 5 j/sem, pendant 2 ans) apparaissent des tumeurs bénignes (adénomes et fibroadénomes) des glandes mammaires (dans les 2 sexes) et des sarcomes sous-cutanés, localisés dans le cou des mâles seulement, à la plus forte concentration [41, 34].
- chez la souris (2000 - 4000 ppm, 6 h/j, 5 j/sem, pendant 2 ans), on remarque une augmentation significative de l'incidence et de la multiplicité des tumeurs alvéolaires et bronchiolaires (adénomes et carcinomes) dans les deux sexes, concentration-dépendante. Au niveau hépatique, à la plus forte concentration, l’incidence des adénomes est significativement augmentée chez les femelles et celle des carcinomes pour les 2 sexes[34]. Dans une étude menée plus récemment, les souris ont été exposées à 1000-2000 ou 4000 ppm pendant 2 ans (6 h/j, 5 j/sem). Sont rapportées une augmentation des carcinomes hépatocellulaires à la plus forte dose chez les mâles et les femelles, une hausse de l’incidence des adénomes/hépatoblastomes/carcinomes (combinés) chez les mâles et une augmentation de l’incidence des adénomes/carcinomes (combinés) à la forte concentration chez les femelles exposées. Une augmentation de l’incidence des hémangiomes hépatiques (mâles, plus forte dose) et des hémangiomes/hémangiosarcomes combinés (femelles, plus forte dose) est aussi mesurée [42, 43].
Et par voie orale :
- chez le rat (jusqu'à 250 mg/kg pc/j pendant 2 ans dans l'eau de boisson), seules les femelles présentent une légère augmentation des tumeurs hépatiques (carcinomes hépatocellulaires et des nodules néoplasiques), mais non significative par rapport aux témoins [37]. Une exposition par gavage (500 mg/kg/j dans l'huile, 4 ou 5 j/sem, pendant 64 semaines n'induit pas de tumeurs [40].
- chez la souris : une augmentation significative des carcinomes hépatocellulaires est notée chez les mâles, mais pas chez les femelles après exposition à 250 mg/kg pc/j dans l'eau de boisson pendant 104 semaines [36]. Un gavage (500 mg/kg pc/j dans l'huile, 4 ou 5 j/sem, pendant 64 sem) provoque une augmentation significative de l'incidence des adénomes ou carcinomes pulmonaires chez les mâles morts à la 78ème semaine seulement ; aucune tumeur n’est observée chez les femelles [40].
Le CIRC a classé le dichlorométhane dans le groupe 2A, probablement cancérogène pour l’homme, sur la base des preuves suffisantes chez l’animal. De plus, il est bien établi que le métabolisme du dichlorométhane via la GSTT1 conduit à la formation de métabolites réactifs, que l’activité de la GSTT1 est fortement liée à la génotoxicité in vitro et in vivo et que cette voie métabolique existe chez l’Homme [38].
Effets sur la reproduction [15, 16, 17]
Le dichlorométhane traverse la barrière placentaire et augmente le taux de carboxyhémoglobine dans le sang fœtal. Il n'a pas d'effet sur la fertilité des animaux ni sur le développement des petits. En présence de toxicité maternelle, il induit une baisse de poids des fœtus et un léger retard d'ossification.
Fertilité
Aucun effet sur les fonctions de reproduction n’est observé chez des rats exposés à des concentrations de dichlorométhane allant jusqu'à 1500 ppm durant deux générations (0-100-500 ou 1500 ppm, 6 h/j, 5 j/sem] [44, 45]. Dans un test de létalité dominante, aucune lésion n’est décelée dans les testicules des souris mâles exposées à 200 ppm durant 6 semaines [39].
Une atrophie de l'utérus, des ovaires et des testicules est observée chez des rats et des souris exposés à 4000 ppm de vapeurs de dichlorométhane durant deux ans (6 h/j, 5 j/sem). Toutefois, les auteurs ont considéré ces effets comme étant secondaires au développement de tumeurs hépatiques et alvéolaires [34].
Par voie orale (rats, 125 mg/l dans l'eau de boisson, 13 semaines avant l'accouplement), le dichlorométhane n'induirait aucune modification de l'index de fertilité des femelles ni de la survie des petits (étude dont seul un résumé incomplet est disponible) [26].
Développement
Le dichlorométhane traverse la barrière placentaire et est métabolisé en monoxyde de carbone par le fœtus. Aucune anomalie organique n’est décelée chez des fœtus de souris et de rats exposés à 1 250 ppm durant la gestation (7 h/j du 6ème au 15ème jour de gestation), mais un léger retard d'ossification est observé dans les deux espèces (pelvis rénal dilaté chez le rat et sternèbres supplémentaires chez la souris) en présence de toxicité maternelle (augmentation du poids du foie et du taux de carboxyhémoglobine -12 %) [46].
Après exposition de rats à 4500 ppm pendant la gestation (du 1er au 17ème jour, 6 h/j), aucun effet embryotoxique ou tératogène n’est observé malgré une augmentation de poids du foie chez les mères et une baisse de poids fœtal. Aucun effet n'est montré sur le poids à la naissance et jusqu'à environ 1 an ; cependant, une modification de l'activité (hypo- et hyperactivité) est observée au 10ème jour et persiste chez les mâles jusqu'à 5 mois. Il n'est pas clairement défini si cette altération est due à l'exposition in utero au dichlorométhane ou au monoxyde de carbone (HbCO entre 7,1 et 10,1 % chez les mères)[47]. La survie, la croissance, l'apprentissage et le comportement des petits ne sont pas modifiés par une exposition à 1500 ppm pendant deux générations (0-100-500 ou 1500 ppm, 6 h/j, 5 j/sem] [44, 45].
Par voie orale (0,04 - 0,4 - 4 % dans la nourriture du 1er au 20ème jour de gestation, correspondant à 134 – 1394 et 13626 mg/jour), le dichlorométhane provoque une diminution du poids maternel et une baisse de poids fœtal à la forte dose, mais pas de malformation externe ni de retard d'ossification [26].
Toxicité sur l’HommeLe dichlorométhane provoque une dépression du système nerveux central, pouvant être fatale en cas d’exposition importante à des vapeurs et aérosols. Il est irritant pour les muqueuses et la peau. L’exposition répétée peut provoquer des troubles des fonctions neurologiques et des dermatites d’irritation. Des manifestations d’intoxication oxycarbonée peuvent être observées. Le caractère cancérogène du dichlorométhane seul est difficile à évaluer, bien qu’un excès de certains cancers ait été suggéré dans quelques études chez l’Homme. Il n'est pas possible de conclure sur les effets toxiques sur la reproduction de la substance ; il faut cependant noter le caractère tératogène du monoxyde de carbone, métabolite du dichlorométhane.
Toxicité aiguë [48, 49, 50, 16et51]
Lors de l’exposition à des vapeurs et aérosols de dichlorométhane, les effets observés se caractérisent principalement par une irritation des muqueuses (toux, irritation nasale et oculaire) et un effet dépresseur du système nerveux central (sensation d’ivresse, céphalées, nausées, vertiges, somnolence, diminution des performances neurocomportementales). L'inhalation de concentrations importantes (plusieurs centaines ou milliers de ppm) provoque des intoxications graves, potentiellement mortelles [52].
Des complications anoxiques en lien avec l’intoxication secondaire par le CO, peuvent être observées (troubles du rythme cardiaque, angor, infarctus du myocarde ou accidents anoxiques cérébraux), surtout en cas de problème cardiovasculaire préexistant (notamment insuffisance coronaire, athérosclérose). La carboxyhémoglobinémie s’élève généralement de façon retardée (quelques heures) et modérée (d’environ 10 %), mais peut atteindre dans certains cas des valeurs supérieurs à 40 % [53].
Des lésions hépatiques et rénales non spécifiques peuvent être observées lors des accidents graves. Des cas d’hépatotoxicité observés par le passé ont été attribués à des impuretés du produit technique.
Le contact cutané est à l’origine d’une irritation, voire de brûlures chimiques dont la sévérité dépend du temps de contact[54, 55].
Des projections oculaires de liquide peuvent être à l’origine de conjonctivites irritatives ou d’érosions de la cornée.
L’ingestion entraine des lésions corrosives du tractus gastro-intestinal, des troubles de conscience et respiratoires (en rapport avec une fausse route), associés parfois à des complications hépatiques, rénales et pancréatiques [56].
Toxicité chronique [48, 49, 16et51]
Les études réalisées sur des travailleurs exposés au dichlorométhane de façon chronique ont souvent concerné un nombre restreint de sujets et avec des co-expositions.
Une irritation des muqueuses oculaires et respiratoires, des modifications des fonctions neurologiques, notamment des symptômes évocateurs d’un syndrome psycho-organique (troubles de la mémoire et de la concentration, troubles de la personnalité) ont été rapportés chez certains travailleurs, notamment pour des expositions supérieures à 100 ppm ou des pics d’expositions au long cours.
Aucune anomalie des fonctions pulmonaire, hépatique et rénale, ni de signes significatifs à l’ECG n'ont été observés chez des volontaires exposés à des vapeurs de dichlorométhane (50 à 500 ppm) pendant 6 semaines.
L’exposition répétée ou prolongée de la peau est à l’origine de dermatites d’irritation limitées aux zones de contact, caractérisées par rougeurs, desquamation et fissurations.
Le dichlorométhane n’est pas à l’origine d’une sensibilisation respiratoire ou cutanée [57].
Le taux de carboxyhémoglobine peut être augmenté. Chez des volontaires sains et non-fumeurs, l'inhalation de dichlorométhane (50 à 200 ppm, 7,5 h/j, 5 jours de suite) provoque une élévation de la carboxyhémoglobinémie qui reste inférieure à 7 % [23] ; l’exposition moyenne à 50 ppm de dichlorométhane correspond à une carboxyhémoglobinémie d’environ 3-4 % chez les non-fumeurs [32].
Le rôle du dichlorométhane dans le risque de sclérose latérale amyotrophique chez des travailleurs exposés à plusieurs solvants est discuté[58].
- Effets perturbateur endocrinien
Aucune étude chez des travailleurs exposés au dichlorométhane n’a été identifiée à la date de publication de cette fiche.
Effets génotoxiques
Aucune étude de génotoxicité chez des travailleurs exposés au dichlorométhane n’a été identifiée à la date de publication de cette fiche.
Effets cancérogènes [38, 57]
Quelques études épidémiologiques retrouvent des associations entre l’exposition au dichlorométhane et certains cancers digestifs (voies biliaires, foie) et du système hématopoïétique (lymphomes non-Hodgkiniens), alors que d’autres ne retrouvent pas d’association. Elles sont limitées par le petit nombre de cas et la co-exposition des salariés à d’autres produits chimiques.
D’autres localisations de cancer ont aussi été étudiées (principalement cerveau et autres parties du système nerveux central, ainsi que poumon, cou, sein, reins et pancréas). Globalement, ces études ne montrent pas d'excès significatif de cancer ou ne permettent pas de conclure, surtout à cause de l’impossibilité d’évaluer l'importance relative de différents facteurs de risque potentiels.
Effets sur la reproduction [59, 48]
Un cluster de 4 cas d’oligospermie a été identifié dans un groupe de 34 travailleurs dans l’industrie automobile, présentant tous des troubles du système nerveux central [60]; cette anomalie du spermogramme n’a pas été observée dans une autre étude réalisée chez 11 salariés, exposés à des concentrations de dichlorométhane deux fois supérieures, lors de la manipulation de décapants [61].
Le risque d’avortements spontanés chez les femmes exposées dans les années 70 – 80 au dichlorométhane dans l’industrie pharmaceutique, les laboratoires universitaires et autres professions est discuté, n’atteignant pas des valeurs statistiquement significatives [62 à 65]. Dans un contexte de multiexposition, la distinction des effets induits par le dichlorométhane seul de ceux résultants d’une exposition à d’autres substances est difficile, d’autant plus que l’exposition aux solvants organiques dans leur ensemble a était associée à une augmentation de ce risque.
Les données disponibles concernant les risques de retard de croissance fœtale et de malformations, notamment du tube neural, lors de l’exposition maternelle aux solvants chlorés restent imprécises et ne permettent pas d’évaluer le rôle du dichlorométhane. Toutefois, on tiendra compte du retentissement embryo-fœtal du monoxyde de carbone (métabolite du dichlorométhane) en cas de forte exposition potentielle d'une femme enceinte.
Cohérence des réponses biologiques chez l'Homme et l'animal -
