Pathologie - Toxicologie
-
Toxicocinétique - Métabolisme [1, 15]
L’acétonitrile est bien absorbé dans l’organisme, largement distribué et métabolisé, principalement dans le foie, en cyanure d’hydrogène ; il se fixe aux macromolécules cellulaires ou est excrété dans l’air expiré sous forme inchangée et dans l’urine sous forme inchangée ou métabolisée, libre ou conjuguée.
Chez l'animal
Absorption
Bien qu’il n’y ait pas de donnée quantitative, la toxicité systémique observée permet de penser que l’acétonitrile est facilement absorbé, chez l’Homme comme chez l’animal, par voies gastro-intestinale, pulmonaire et cutanée.
Distribution
L’acétonitrile se distribue largement dans l’organisme. Chez le rat, le pic sanguin est atteint 7,5 heures après une exposition orale et la disparition du sang est quasi totale après 72 heures.
Chez la souris, après une injection intraveineuse d’acétonitile radiomarqué, les taux les plus élevés sont retrouvés dans le foie et les reins au bout de 5 minutes et, après 24 à 48 heures, dans le tractus gastro-intestinal, le thymus, le foie et les organes reproducteurs. Dans le foie, 40 à 50 % de la radioactivité est fixée aux macromolécules tissulaires après 24 et 48 heures ; dans les autres organes, une grande partie est présente dans la fraction lipidique tissulaire. Il ne semble pas y avoir d’accumulation dans les tissus.
Métabolisme
L’acétonitrile est métabolisé, dans tous les tissus avec une prédominance dans le foie, par le système de monooxygénases à cytochrome P450 en cyanhydrine de méthyle instable qui se décompose en formaldéhyde et cyanure d’hydrogène ; celui-ci est, par la suite, conjugué avec du thiosulfate pour former du thiocyanate (voir fig. 1). La transformation en cyanure d’hydrogène est dépendante du taux d’oxygène et de NADPH ; elle est inactivée par la chaleur et inhibée par le NADH. Elle est plus lente que celle des autres nitriles et de vitesse variable selon les espèces (la souris étant la plus rapide).
Schéma métabolique
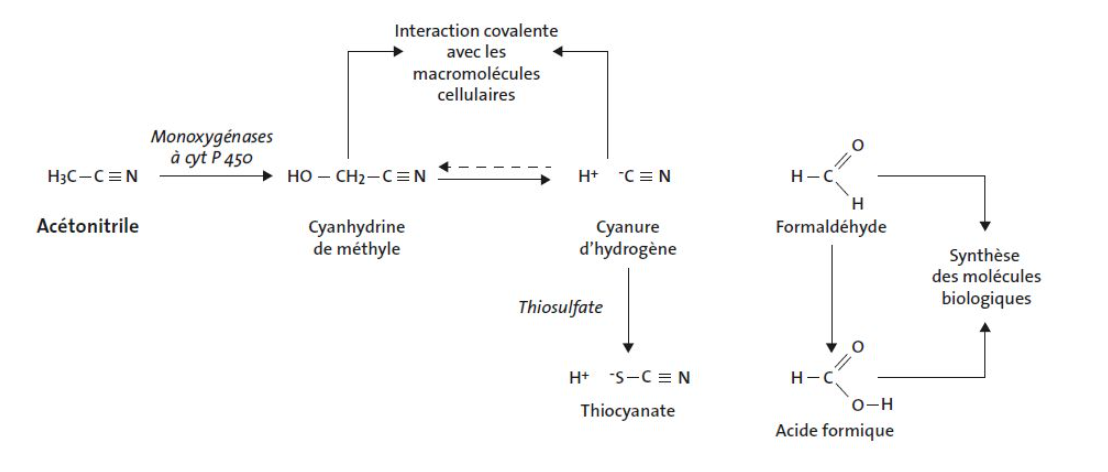
Fig. 1 : Métabolisme de l'acétonitrile [1].
Excrétion
L’acétonitrile est excrété sous forme inchangée dans l’air expiré (principalement lors de fortes expositions) et dans l’urine ainsi que sous forme de métabolites libres ou conjugués dans l’urine. Il est éliminé des tissus avec une cinétique d’ordre 1 et une demi-vie allant de 5,52 heures dans le foie à 8,45 heures dans le sang. Ses métabolites sont éliminés des tissus avec une cinétique d’ordre 2 et des demi-vies plus longues, allant de 8,6 heures dans la vessie à 536 heures dans les tissus de l’intestin grêle.
L’élimination urinaire de l’acétonitrile est la plus importante dans les 24 heures qui suivent l’exposition, de faibles quantités sont recueillies chez le rat après 4 jours ; l’excrétion de cyanure d’hydrogène et de thiocyanate se poursuit pendant au moins 11 jours et correspond à 12 - 37 % de la dose orale administrée. Chez l’Homme, après ingestion volontaire, les demi-vies d’élimination urinaire sont 32 heures pour l’acétonitrile et 15 heures pour le cyanure d’hydrogène. Des concentrations de 22 à 200 μg d’acétonitrile/L d’urine ont été mesurées chez les grands fumeurs [15].
Chez l'Homme
Chez l'Homme, 74 % de l'acétronitrile contenu dans la fumée de cigarette est absorbé si cette dernière est conservée dans la bouche et 91 % si elle est inhalée dans les poumons.
Mode d'actions
L’acétonitrile n’est pas ou peu toxique par lui-même ; sa toxicité est liée à la production de cyanure d’hydrogène, ce qui explique le délai d’apparition des signes cliniques. Le cyanure d’hydrogène est un poison de la respiration cellulaire provoquant des convulsions et l’arrêt respiratoire. La souris est l’animal qui métabolise l’acétonitrile le plus rapidement, c’est aussi le plus sensible à sa toxicité.
Interférences métaboliques
Le métabolisme de l’acétonitrile est inhibé par le monoxyde de carbone et l’éthanol ; l’acétone a un effet biphasique : inhibition puis induction du métabolisme (par induction de l’isoenzyme Cyt P450), ce qui provoque une augmentation de la toxicité chez l’animal.
Toxicité expérimentale [1, 15]Toxicité aiguë
En exposition aiguë, l’acétonitrile a pour cible le système respiratoire des animaux avec une sensibilité, variable selon l’espèce et l’âge, liée à la présence de cyanure d’hydrogène.
La susceptibilité de diverses espèces animales à la toxicité de l’acétonitrile est très variable (voir tableau 1), la souris et le cobaye semblent les plus sensibles ; chez le rat, les animaux immatures sont plus sensibles que les adultes.
Les symptômes principaux sont une prostration suivie de perte de connaissance et des convulsions. La cible de l’acétonitrile est le système respiratoire, avec pour conséquence une respiration laborieuse, rapide et irrégulière. Ces effets pourraient être liés à la formation de cyanure d’hydrogène lors de la métabolisation de l’acétonitrile. Après exposition par inhalation, on observe, chez le chien, en plus des symptômes principaux, une hémorragie pulmonaire et une congestion vasculaire et, chez la souris, le rat et le cobaye, des tremblements, une hypersalivation et une irritation oculaire. Aucune modification histopathologique n’a été observée chez ces animaux.
La toxicité de l’acétonitrile en solution diluée, par voie orale ou cutanée, est plus importante que celle de la substance pure. L’acétonitrile est irritant pour les yeux du lapin (rougeur et œdème de la conjonctive, légère opacité cornéenne, réversibles en 21 jours) et non irritant pour la peau intacte (0,5 mL, 4 heures) ; il n’est pas sensibilisant pour le cobaye (test de Buehler).
Voie Espèce DL50 - CL50 Orale Rat adulte
Rat immature
Souris
Cobaye
3081 - 6762 mg/kg
158 mg/kg
289 - 617 mg/kg
140 mg/kg
Inhalation Rat
Souris
Cobaye
Lapin
Chien
26 880 mg/m3 (15 993 ppm)
6026 mg/m3 (3587 ppm)
9500 mg/m3 (5652 ppm)
4751 mg/m3 (2827 ppm)
13440 - 26 880 mg/m3 (7800 - 15 993 ppm)
Cutanée Lapin Non dilué : 987 à 2000 mg/kg
Solution à 75 % : 395 mg/kg
Tableau 1 : DL50 et CL50 de l'acétonitrile
Toxicité subchronique, chronique [1, 15]
L’acétonitrile, en exposition répétée ou prolongée, a pour cibles les poumons, le foie, l’estomac et le sang.
L’exposition répétée par inhalation des animaux à l’acétonitrile pendant 13 semaines (6-7 h/j, 5 j/sem) provoque anomalie de posture, ataxie et convulsions. La létalité apparaît chez le rat à partir de 800 ppm, la souris à partir de 400 ppm (létalité totale à 1600 ppm) et le singe à partir de 660 ppm (après 2 semaines, à 2 510 ppm après 2 jours).
Les principaux effets sont observés sur :
- les poumons : augmentation du poids relatif chez la souris, congestion, œdème, hémorragie alvéolaire chez le rat (≥ 800 ppm) ; chez le singe, pneumonie chronique (330 ppm), emphysème focal et atélectasie avec prolifération occasionnelle du septum alvéolaire (660 ppm), engorgement des capillaires et effusion pleurale (2510 ppm) ; chez le chien, léger emphysème focal et prolifération du septum alvéolaire (350 ppm) ;
- le cerveau : hémorragie cérébrale chez le rat (observée chez les animaux qui meurent dans les premières semaines d’exposition à 1 600 ppm) et hémorragie locale durale ou sous-durale ainsi que des sinus sagittaux supérieurs chez le singe (330 ppm) ;
- le sang : chez le rat, anémie normochrome (femelles ≥ 800 ppm, mâles 160 ppm) ; chez le chien baisse de l’hématocrite et du taux d’hémoglobine sans modification du nombre des globules rouges ;
- le foie : chez le rat, augmentation de poids absolu (femelles 1600 ppm) ; chez la souris, augmentation de poids relatif et absolu (≥ 200 ppm), vacuolisation cytoplasmique des hépatocytes (≥ 400 ppm) ;
- l’estomac : chez la souris, hyperplasie épithéliale focale à multifocale du pré-estomac, ulcération quelquefois associée à un dépôt d’hémosidérine, hyperkératose et infiltration de cellules inflammatoires (femelles ≥ 200 ppm, mâles ≥ 800 ppm), ulcères focaux (femelles 1 600 ppm) ;
- les reins : chez le rat, augmentation de poids absolu (femelles 1600 ppm) ; chez le singe, dégénérescence albumineuse des cellules du tube rénal contourné proximal ;
- le thymus : diminution du poids relatif chez le rat (≥ 800 ppm) ;
- le cœur : augmentation du poids relatif chez le rat (femelles 1600 ppm) ;
- diminution du taux de triiodothyronine (T3) sérique chez le rat (femelles 1600 ppm), sans modification du taux de T4 ou de TSH.
Une exposition pendant 103 semaines (6 h/j, 5 j/sem), provoque, chez le rat (0-100-200-400 ppm), des altérations hématologiques (diminution du volume cellulaire et de l’hémoglobine, augmentation du nombre de globules rouges (mâles) et diminution de l’hématocrite (femelles), non fonction de la concentration) et chez la souris (0-50- 100-200 ppm), l’augmentation de l’hyperplasie squameuse du pré-estomac (femelles, 200 ppm) ; les effets hépatiques, observés après 13 semaines, disparaissent après 15 mois.
La NOAEL est de 400 ppm chez le rat, 100 ppm chez la souris femelle et 200 ppm chez le mâle, inférieure à 330 ppm chez le singe.
Effets génotoxiques [1, 15]
In vitro, l’acétonitrile n’induit pas de mutation génique et présente une faible activité clastogène dans les cellules de mammifère en culture ; il occasionne une aneuploïdie par interférence avec la division des chromosomes in vitro et in vivo.
In vitro, l’acétonitrile donne des résultats négatifs dans le test d’Ames sur Salmonella typhimurium avec ou sans activation métabolique, avec ou sans préincubation. Il n’est pas mutagène, avec ou sans activation métabolique, pour les cellules ovariennes de hamster chinois (CHO) ou les cellules de lymphome de souris. Dans les cellules ovariennes de hamster chinois (CHO), à forte dose, il provoque une légère augmentation, considérée comme équivoque, des échanges entre chromatides sœurs sans activation métabolique et des aberrations chromosomiques après activation.
L’acétonitrile entraîne une aneuploïdie chez Saccharomyces cerevisiae ; il provoque des pertes de chromosomes mais ni recombinaison génique ni mutation. L’aneuploïdie serait liée à la faculté de bloquer, au niveau du fuseau mitotique, l’assemblage de la tubuline et la formation des microtubules.
In vivo, l’acétonitrile induit une aneuploïdie chromosomique (perte et gain de chromosomes) dans les ovocytes de la drosophile femelle. Il n’y a pas de synthèse non programmée de l’ADN dans les hépatocytes de rat exposés. Des résultats légèrement positifs, à forte dose, sont obtenus dans le test du micronoyau dans la mœlle osseuse de la souris (injection ip 500 mg/kg) et négatifs à des doses inférieures (injection ip 100-125 mg/kg) ; par inhalation (100-200-400-800 ppm, 13 semaines), des micronoyaux sont détectés de façon significative à une seule dose (400 ppm) et chez le mâle uniquement. Une légère augmentation des érythrocytes polychromatiques dans le sang de ces animaux témoigne d’un stress subi par la mœlle osseuse.
Effets cancérogènes [1, 15, 16]
L’acétonitrile n’est pas considéré comme cancérogène ; il provoque chez le rat mâle un développement de foyers hépatiques et une augmentation marginale des adénomes et/ou carcinomes hépatiques ; chez la souris, il induit une hyperplasie squameuse du pré-estomac.
L’exposition du rat (0-100-200-400 ppm, 6 h/j, 5 j/sem, 103 sem), à l’acétonitrile par inhalation provoque, chez le mâle, une augmentation du taux des foyers hépatiques basophiles, d’apparence bénigne (≥ 200 ppm) et une augmentation marginale du taux d’adénomes et carcinomes hépatocellulaires (400 ppm) ; il n’y a pas d’évidence d’activité cancérogène chez le rat femelle.
Chez la souris (50, 100, ou 200 ppm, 6 h/j, 5 j/sem, 103 sem) l’acétonitrile provoque une augmentation significative du taux d’adénomes ou d’adénomes et de carcinomes alvéolaires/bronchiolaires chez les mâles (200 ppm), mais pas chez les femelles ; cet effet n’est pas considéré par le NTP (National Toxicology Program) comme lié à l’exposition. Il induit, également chez le mâle, une augmentation signifi cative, à une dose seulement (100 ppm), du taux d’adénomes et de carcinomes hépatiques ; le manque de relation effet-dose et l’absence de facteurs diminuant la réponse néoplasique (baisse de poids par exemple) rend ce résultat équivoque. Dans le pré-estomac, il occasionne une hyperplasie squameuse, en relation effet-dose (≥ 100 ppm femelles, 200 ppm mâles), et une augmentation légère, à la limite supérieure des témoins historiques, du taux de papillomes à cellules squameuses (≥ 100 ppm).
La toilette de la fourrure et la clairance mucociliaire génèrent une ingestion d’acétonitrile qui pourrait jouer un rôle dans les effets sur le pré-estomac.Effets sur la reproduction [1, 15, 16]
Dans la plupart des espèces, l’acétonitrile provoque des résorptions embryonnaires en présence de toxicité maternelle ; il n’induit pas de malformation chez le rat et les réponses sont équivoques chez le hamster.
Il n’y a pas d’étude spécifique sur les effets de l’acétonitrile sur la fertilité ; cependant, lors d’une étude sur 13 semaines, le NTP n’a observé aucun effet sur le poids de l’épididyme ou du testicule droit ni sur la mobilité spermatique après exposition par inhalation du rat et de la souris (100-200-400 ppm).
Les effets de l’acétonitrile sur le développement ont été mesurés pour trois espèces :
- chez le rat exposé par inhalation, il est toxique pour les mères (diminution de la prise de poids, mortalité) et provoque, à forte concentration (1800 ppm), une augmentation du pourcentage d’implants non viables et de résorptions, sans variation viscérale ou squelettique. Par voie orale (0-50-150-300-500 mg/kg/j, intubation du 7e au 21e jour de gestation), il est toxique pour les mères (à partir de 300 mg/kg/j), et les embryons (augmentation des résorptions et diminution du pourcentage de portées viables à 500 mg/kg/j), mais sans induire d’anomalie ;
- chez le lapin, par gavage du 6e au 18e jour de gestation, il est toxique pour les mères et provoque une baisse du nombre moyen de foetus vivants par portée ;
- chez le hamster, exposé par inhalation (0-1800 -3800-5000-8000 ppm au 8e jour de gestation), il est toxique pour les mères à partir de 3800 ppm et augmente les résorptions et les anomalies fœtales (exencéphalie, encéphalocèle, fusion des côtes) à partir de 5000 ppm. L’administration de thiosulfate (300 mg/kg ip, 20 min avant l’inhalation et toutes les 2 h pendant 10 h) pour bloquer le cyanure formé lors de la métabolisation de l’acétonitrile diminue la toxicité maternelle et fœtale, les anomalies sont limitées à la fusion des côtes après exposition à 8000 ppm. Par voie orale ou ip (100 à 400 mg/kg au 8e jour de gestation), des malformations identiques à celles obtenues par inhalation apparaissent sporadiquement et dans un nombre limité de fœtus. Les résultats de cette étude menée avec un protocole non standard sont difficiles à interpréter.
Toxicité sur l’HommeDes atteintes du système respiratoire (détresse respiratoire, séquelles de type pneumonie), des convulsions, une cyanose, un coma parfois mortel, surviennent dans les cas d’intoxication aiguë. Des irritations cutanées et des atteintes du système nerveux central, caractéristiques des solvants organiques, sont observées avec l’acétonitrile lors d’expositions répétées.
Toxicité aiguë [1, 6, 17]
Des volontaires ont été exposés pendant 4 heures à des concentrations de 40 ou 80 ppm d’acétonitrile. Un des sujets sur les 3 exposés à 40 ppm a ressenti quelques heures après la fin de l’exposition une douleur thoracique et, le lendemain, une sensation d’irritation pulmonaire ; il n’a pas été détecté de cyanure sérique chez ces 3 sujets, mais l’un d’entre eux a présenté une faible excrétion urinaire de thiocyanates.
Un sujet exposé pendant 4 heures à 160 ppm a présenté, 2 heures après la fin de l’exposition, une rougeur de la face et, 5 heures après, une légère douleur thoracique sans qu’aient été détectés chez lui des cyanures sériques ou des thiocyanates urinaires.
L’exposition accidentelle brève à une concentration de 500 ppm provoque une irritation du nez et de la gorge.
Des intoxications aiguës graves, dont certaines mortelles [18, 19], sont rapportées lors d’expositions à des concentrations vraisemblablement fortes, mais non chiffrées. Les signes d’intoxication apparaissent plusieurs heures après la fin de l’exposition : douleurs thoraciques et détresse respiratoire, vomissements, hématémèse, troubles moteurs (convulsions, incoordination musculaire), hypotension, cyanose, dépression respiratoire et coma. Chez les sujets décédés, l’autopsie révèle une congestion vasculaire généralisée. Des séquelles respiratoires à type de pneumonie sont fréquemment observées dans les cas graves non mortels.
Les ions « cyanure » formés dans l’organisme à partir de l’acétonitrile interviennent vraisemblablement pour une grande part dans les effets toxiques observés. Par ailleurs, en cas d’intoxications graves, des taux sériques de thiocyanates supérieurs à 120 mg/L ont été retrouvés [20].
Localement, le liquide peut provoquer des irritations cutanées et oculaires sévères.
Toxicité chronique [1]
L’acétonitrile est responsable, comme la plupart des solvants organiques, d’atteintes cutanées à type de dermoépidermite irritative récidivante, avec dessication de la peau, et d’atteintes neurologiques se manifestant par une ébriété, des sensations de vertiges voire des signes de syndrome narcotique.
Par contre, il n’existe pas d’étude publiée en ce qui concerne d’autres atteintes éventuelles chez l’Homme en cas d’exposition à long terme.
Effets cancérogènes
Il n’y a pas d’étude publiée permettant de montrer un effet cancérogène de l’acétonitrile chez l’Homme.
Effets sur la reproduction
Au cours d’une vaste enquête épidémiologique sur des femmes travaillant en laboratoire, les Finlandais n’ont pas mis en évidence d’effet statistiquement significatif sur le nombre de fausses couches des femmes exposées à l’acétonitrile. Cette même étude n’a pas révélé de malformations chez les enfants. Toutefois le nombre de sujets exposés à l’acétonitrile dans cette étude était faible et ne permet pas de conclure de façon définitive [21].
Cohérence des réponses biologiques chez l'Homme et l'animal
