Prélèvement : Surfacique sur lingette
Analyse : fluorimétrie
Données de validation : Validation complète
Substances
Informations générales
Propriétés physico-chimiques
| Nom | N° CAS | Formule chimique | Classification CMR |
|---|---|---|---|
| Béryllium | 7440-41-7 | Be |
C1B |
Plus d'informations
| Nom | Masse molaire | Densité | Synonymes | Fiche toxicologique |
|---|---|---|---|---|
| Béryllium | 9,01 |
Familles de substances
- METALLOIDES
- METAUX
Principe et informations
Pour évaluer les risques de contamination cutanée, des prélèvements surfaciques peuvent être réalisés par essuyage des plans de travail, des mains ou visage des opérateurs à l’aide de lingettes imprégnées.
Le béryllium est ensuite extrait des échantillons par l’ajout de NH4HF2 1% pendant 4h à 80°C. Cette température permet d'éviter la dégradation des lignettes. Après refroidissement à température ambiante et filtration, une aliquote de ces solutions est ajoutée à un volume de solution de détection contenant le réactif fluorimétrique (HBQS : 10-hydroxybenzo[h]quinone-7-sulfonate) pour former un complexe selon la réaction :
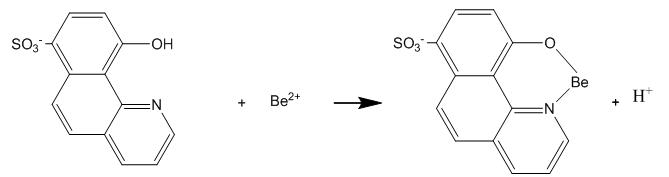
Ces solutions sont analysées immédiatement par fluorimétrie (pas de conservation possible après ajout de la solution de détection).
Cette méthode a été mise au point pour permettre la mise en solution et l’analyse de faibles quantités de béryllium (10 ng/lingette).
Elle a été validée pour des quantités dosées sur le support comprises entre 10 ng et 4 µg. Cette méthode a été validée entièrement pour BeF2 et BeO, les rendements d’extractions 4h à 80°C seront à revérifier si d’autres composés de Be sont utilisés.
Remarques :
- Au Québec, une valeur seuil de contamination surfacique au béryllium et ses composés de 0,2 µg/100cm² (diagnostic présence Be) a été définie.
- Toutes les données de validation ainsi que les calculs des performances de la méthode sont indiqués dans les données de validation.
Précautions particuliaires :
Une attention particulière sera apportée lors de la manipulation du béryllium sous forme de poudre. Pour ce faire le poste de pesée devra être placé sous sorbonne et pour éviter toute exposition, l’opérateur devra se munir d’une blouse jetable, 2 paires de gants et d’un masque type P3.
Principe de prélèvement et d'analyse
-
État physique
Particules en suspension (liquides ou/et solides) -
Type de prélèvements
Surfacique -
Nom du dispositif
lingette -
Technique analytique
FLUORIMETRIE
Domaine d'application
| Substance | Quantité minimum sur le dispositif | Quantité maximum sur le dispositif | Concentration minimum | Concentration maximum | Volume maximum |
|---|---|---|---|---|---|
| Béryllium | 10 ng |
4 µg |
Réactifs
- 10-HYDROXYBENZO[H]QUINONE-7-SULFONATE (HBQS)
- ACIDE CHLORHYDRIQUE
- ACIDE NITRIQUE
- BERYLLIUM
- DIFLUORURE D'AMMONIUM
- EAU
- ETHYLENE DIAMINE TETRA-ACETIQUE SODIUM SEL (EDTA)
- HYDROXYDE DE SODIUM
- L-LYSINE MONOHYDROCHLORIDE
- SOLUTION ETALON 1g/L
Méthode de prélèvement
Un dispositif de prélèvement :
Dispositif N°1
-
Type dispositif
LINGETTE -
Support ou substrat de collecte
-
Commentaires, conseils et consignes
Lingette d’essuyage imprégnée d’une solution mouillante, dont le contenu en élément recherché est aussi faible que possible.
Compléments
Les prélèvements de surface sont réalisés suivant les recommandations de la norme NF X46-032 du 2008-04-01 et de l'ASTM (American Society for Testing and Materials). Un exemple de protocole pour l'essuyage main, cou et visage est décrit dans les données de validation - prélèvement surfacique.
Méthode d'analyse
Principe général de l'analyse en laboratoire
Préparation d'analyse
-
Durée de conservation prélèvements avant analyse
1 mois -
Nombre d'étapes de préparation
2 -
Commentaires sur les étapes
La première étape décrit l'extraction du polluant sur le support.
La seconde étape décrit le traitement de l'extrait juste avant le dosage.
-
Durée de conservation échantillon préparé avant analyse
1 mois -
Conditions de conservation échantillon préparé avant analyse
Les lingettes ainsi que les solutions d’extraction de ces supports peuvent être conservés un mois sans pertes significatives.
Une fois le mélange avec la solution de détection réalisé, les cuvettes doivent être analysées dans la journée.
Voir les données de validations pour plus d'information.
2 étapes de préparation :
Étape de préparation N°1
-
Solvant ou solution
- DIFLUORURE D'AMMONIUM
-
Type de préparation
Extraction -
Volume
10 mL -
Autres conditions de préparation
- Transférer les lingettes dans des tubes propres résistants à au moins 80°C
- Ajouter 10 mL de NH4HF2 1 % puis placer les tubes pendant 4 h dans le système de minéralisation d’échantillon préalablement chauffé à 80°C.
- Une fois le temps de minéralisation écoulé, retirer les tubes et les laisser refroidir à température ambiante.
Remarques :
- Traiter les blancs de laboratoire et les blancs de terrain de la même façon.
- Il est très important de vérifier la température de chauffe de l’appareil utilisé ; si les lingettes sont chauffées au-delà de 80°C pendant 4h, elles se solubilisent et donnent un liquide très visqueux impossible à filtrer et à analyser.
- Attendre le refroidissement complet des solutions avant réaction avec la solution de détection.
-
Filtration
Filtrer les échantillons avant mélange avec la solution de détection.
Étape de préparation N°2
-
Autres conditions de préparation
Préparation de la solution de détection à partir du produit HBQS de synthèse :
Pour 200mL de solution
- Préparer une solution NaOH 0,1N en solubilisant 0,4 g de NaOH pur dans 100 mL d’eau ultra-pure.
- Peser 7,5 mg d’HBQS synthétisé et les dissoudre dans 25 mL de solution NaOH 0,1N
- Préparer une solution de NaOH 10N en solubilisant 4 g de NaOH pur dans 10 mL d’eau ultra-pure.
- Dissoudre 0,199 g d’EDTA, 2H2O dans 50 mL d’eau ultra-pure (Ultrasons)
- Préparer une solution de L-lysine en solubilisant 1,954 g dans 75 mL d’eau ultra-pure. Ajuster le pH à 12,8 avec NaOH 10N et jauger à 100 mL avec de l’eau ultra-pure.
Mélange final :
- Mélanger 12 mL de solution HBQS + 100 mL de solution de L-lysine + 50 mL de solution d’EDTA.
- Ajuster le pH à 12,8 avec NaOH 10N et compléter à 200 mL avec de l’eau ultra-pure.
- Conserver la solution à 4°C à l’abri de la lumière.
Remarque :
Selon le nombre d’analyses prévu, un volume plus important de solution de détection peut être préparé. La solution reste stable au moins un an si elle est conservée à 4°C à l’abri de la lumière (Voir données de validation - Compléments).
Complexation :
Juste avant le dosage, préparer les échantillons comme suit :
- Filtrer les solutions puis diluer avec la solution de détection directement dans les cuvettes semi-micro, en prélevant 800 ou 950 µL de solution de détection auxquels on ajoute 200 ou 50 µL d’échantillon (selon la gamme d’étalonnage préparée).
- Agiter en aspirant plusieurs fois la solution dans la cuvette. Mettre en place les bouchons pour éviter l’évaporation pendant la préparation de toute la série à analyser.
-
En présence de certains métaux comme le fer, une coloration jaune or apparait lorsque l’on ajoute la solution de détection ce qui peut modifier la réponse obtenue. Dans ce cas laisser la réaction se prolonger pendant 2 heures et re-filtrer dans une nouvelle cuvette pour éliminer le précipité jaune obtenu et analyser.
Après avoir passé la gamme d’étalonnage, doser les échantillons.
Diluer si nécessaire les échantillons avec NH4HF2 1%, avant réaction avec la solution de détection, de façon à rester dans la gamme d'étalonnage.
Si seule une gamme haute a été réalisée et que les résultats sont très faibles, pour plus de précision, analyser à nouveau les échantillons en réalisant une gamme basse.
Remarque :
Les concentrations de NH4HF2 ne doivent pas être modifiées, la réaction fluorimétrique ayant lieu à un pH précis.
Une condition analytique :
Condition analytique N°1
-
Technique analytique
- FLUORIMETRIE
-
Commentaires, conseils ou condition particulières
λ filtre d’excitation entre 360 nm et 380 nm
λ filtre d’émission entre 440 nm et 490 nm
Étalonnage et expression des résultats
La méthode d'étalonnage indiquée est celle utilisée lors du développement. Elle n'a cependant pas de caractère obligatoire
-
Principe d'étalonnage
externe -
Solvant de l’étalon
- Même solvant que celui des échantillons
-
Commentaires
Préparation des solutions Étalons
Les solutions étalons sont préparées à partir de la solution à 1 g/L fabriquée au laboratoire (Voir données de validation). L'étalonnage peut être réalisé également en utilisant les solutions fournies dans le kit Berylliant (https://www.berylliant.com) ou une solution de Be à 1g/L en ayant vérifier la réponse de l'appareil (certains composants peuvent parfois interférer).
Dans un premier temps, diluer la solution à 1 g/L dans NH4HF2 1% pour obtenir une solution S1 à 10 mg/L puis une solution S2 à 1 mg/L puis une solution S3 à 0,05 mg/L. Les dilutions sont réalisées dans NH4HF2 à 1%.
Deux gammes d’étalonnage peuvent ensuite être réalisées.
Gamme basse :
A partir des solutions S2 et S3, préparer au moins 5 solutions d’étalonnage pour couvrir une gamme de concentrations en béryllium de 0 à 50 µg/L et une solution correspondant au blanc réactif.
Ensuite mélanger chaque étalon avec la solution de détection en prélevant 800 µL de solution de détection et 200 µL d’étalon directement dans les cuvettes semi-micro. Agiter en aspirant plusieurs fois la solution dans la cuvette. Mettre en place les bouchons pour éviter l’évaporation pendant la préparation de toute la série à analyser.
Tracer la droite d'étalonnage.
Gamme haute :
A partir des solutions S1 et S2, préparer au moins 6 solutions pour couvrir une gamme de concentrations en béryllium de 0 à 800 µg/L et une solution correspondant au blanc réactif.
Ensuite mélanger chaque étalon avec la solution de détection en prélevant 950 µL de solution de détection et 50 µL d’étalon directement dans les cuvettes semi-micro. Agiter en aspirant plusieurs fois la solution dans la cuvette. Mettre en place les bouchons pour éviter l’évaporation pendant la préparation de toute la série à analyser.
Tracer la droite d'étalonnage.
Compléments
Remarques :
La reconstitution de la matrice est obligatoire pour les lingettes.
Des exemples d'étalonnage sont décrits dans les données de validation.
Les cuvettes préparées doivent être analysées dans la journée (voir données de validation - compléments).
Bibliographie
- NF EN 482 – Exposition sur les lieux de travail. Exigences générales concernant les performances des procédures de mesure des agents chimiques. La Plaine Saint Denis, Association française de normalisation (AFNOR), 2012, 18 p.
- NF EN 13890 – Exposition sur les lieux de travail. Procédures pour le mesurage des métaux et métalloïdes dans les particules en suspension dans l'air - Exigences et méthodes d'essai. La Plaine Saint Denis, Association française de normalisation (AFNOR), 2009, 36 p.
- ANSES (Agence nationale de sécurité sanitaire de l’alimentation, de l’environnement et du travail) – Avis de l’Agence nationale de sécurité sanitaire de l’alimentation, de l’environnement et du travail relative à la proposition de valeurs limites d’exposition à des agents chimiques en milieu professionnel : Le béryllium et ses composés. Octobre 2010, 4 pages (www.anses.fr).
- ASTM (American Society for Testing and Materials) Standard E1792-03. Standard specification for wipe sampling materials for lead in surface dust. West Conshohocken, PA: ASTM International; 2002.
- ASTM (American Society for Testing and Materials) D6966-03. Standard practice for collection of settled dust samples using wipe sampling methods for subsequent determination of metals. West Conshohocken, PA: ASTM International; 2003.
- ASHLEY K., AGRAWAL A., CRONIN J., TONAZZI J., McCLESKEY T.M., BURRELL A.K., EHLER D.S. – Ultra-trace determination of beryllium in occupational hygiene samples by ammonium bifluoride extraction and fluorescence detection using hydroxybenzoquinoline sulfonate. Analytica Chimica Acta, 2007, 584, pp. 281-286.
- ASHLEY K., WISE T.J., MARLOW D., AGRAWAL A., CRONIN J., ADAMS L., ASHLEY E., LEE P.A.- Trace beryllium determination in polyvinyl alcohol wipes by extraction and fluorescence detection: interlaboratory analysis. Analytical Methods, 2011, 3, pp. 1906-1909.
- AGRAWAL A., CRONIN J., TONAZZI J., McCLESKEY T.M., EHLER D.S., MINOGUE E.M., WHITNEY G., BRINK C., BURRELL A.K., et al. - Validation of a standardized portable fluorescence method for determining trace beryllium in workplace air and wipe samples. Journal of Environmental Monitoring, 2006, 8, pp. 619-624.
- GIGUERE M.C. – Mise au point d’une méthode d’analyse en fluorescence pour la détermination du béryllium dans l’air en milieu de travail. Mémoire de Maîtrise, Université du Québec à Montréal, 2010, Montréal, Canada, 124 p.
- GIGUERE M.C., LARIVIERE P., DION C., VAN TRA H. – Détermination du béryllium dans l’air en milieu de travail - Mise au point d’une méthode d’analyse en fluorescence. IRSST, 2011, Études et recherches, Rapport R-700, Montréal, Canada, 59 p.
- NIOSH (National Institute of Occupational Safety and Health) - Method 9102: Elements on Wipes. NIOSH Manual of Analytical Methods, 2003, Cincinnati, OH, 4th ed.
Historique
| Version | Date | Modification(s) faisant l’objet | Paragraphes |
|---|---|---|---|
| 126 | fin 2015 | Création |
|
| M-308/V 01 | Janvier 2016 | Mise en ligne Prélèvement lingette Béryllium et ses composés Analyse par fluorimétrie |
|
Date de mise à jour : janvier 2016
