Pathologie - Toxicologie
-
Toxicocinétique - Métabolisme
À la suite d’une exposition par voies orale ou respiratoire, une grande majorité de l’acroléine est absorbée. Sa forte réactivité envers notamment les groupements thiols libres limite sa biodisponibilité dans l’organisme : elle est retrouvée principalement dans le tractus gastro-intestinal. L’acroléine est rapidement métabolisée, entraînant la formation de métabolites conjugués (conjugaison avec le glutathion) dont le potentiel toxique est fortement réduit par rapport à celui de l’acroléine. Les métabolites sont retrouvés principalement dans les urines. L’acroléine peut également être éliminée par voie respiratoire sous forme de dioxyde de carbone ou par les fèces, mais les métabolites fécaux ne sont pas connus.
Chez l'animal
Absorption
Chez le chien, une forte rétention des vapeurs inhalées a lieu dans le tractus respiratoire (80 - 85 %) dont la majorité dans la partie supérieure ; le taux de rétention est indépendant de la fréquence respiratoire [15]. Chez des rats exposés à 0,9 - 9,1 ppm d'acroléine, l'absorption se produit uniquement dans le tractus respiratoire supérieur (entre 70 et 90 %) et diminue avec l'augmentation de la fréquence respiratoire [16, 17].
Par voie orale, l'absorption gastro-intestinale de l'acroléine est de 75 - 86 % chez le rat, après administration d'une dose unique de 2,5 mg/kg ou de doses multiples sur 14 jours ; après administration d'une dose unique de 15 mg/kg, l'absorption est de 53 - 61 % [18].
Aucune information n'est disponible pour la voie percutanée.
Distribution
Quelle que soit la voie d'exposition, la forte réactivité de l'acroléine vis-à-vis de groupements tels que le glutathion entraîne une distribution systémique limitée [4,19].
In vitro, l'acroléine se fixe aux protéines microsomiales en absence de NADPH, alkyle les groupements sulfhydriques libres du cytochrome P450, se fixe à lADN à raison d'une molécule pour 1000 nucléotides (in vivo, chez le rat, la fixation est de 1 molécule pour 40 000 nucléotides) et forme des adduits cycliques avec la désoxyguanosine (1,N2-G), la désoxyadénosine (1,N6-A) et la cytosine monophosphate (3,N4-CMP).
La distribution corporelle, mesurée 168 heures après exposition du rat à la 14C-acroléine par voie orale, a lieu essentiellement dans le foie, l'estomac, les glandes surrénales et les reins ; la radioactivité est plus faible mais significative dans le sang, la rate, les poumons et le tissu adipeux [18].
Métabolisme
Le métabolisme de l'acroléine a été étudié in vitro et in vivo (Fig. 1 page suivante).
In vitro, la molécule est transformée par les enzymes microsomiales en acide acrylique ou en glycidaldéhyde selon le tissu d'origine (oxydation en acide acrylique dans les extraits de foie et en glycidaldéhyde dans les poumons) [20].
In vivo, l'acroléine est principalement conjuguée au glutathion. Les métabolites conjugués ont un potentiel toxique réduit par rapport à l'acroléine [4]. Cette conjugaison serait suivie de plusieurs étapes conduisant à la formation d'acides mercapturiques : acide S-(3-hydroxypropyl) mercapturique (HPMA) ou acide S-(2-carboxyéthyl)mer- capturique (CEMA) [20]. D'autres voies métaboliques minoritaires existent avec formation d'acide acrylique ou de glycidaldéhyde ; in vivo, la formation d'acide acrylique n'est pas directement mesurable du fait de sa dégradation métabolique rapide [21].
Schéma métabolique
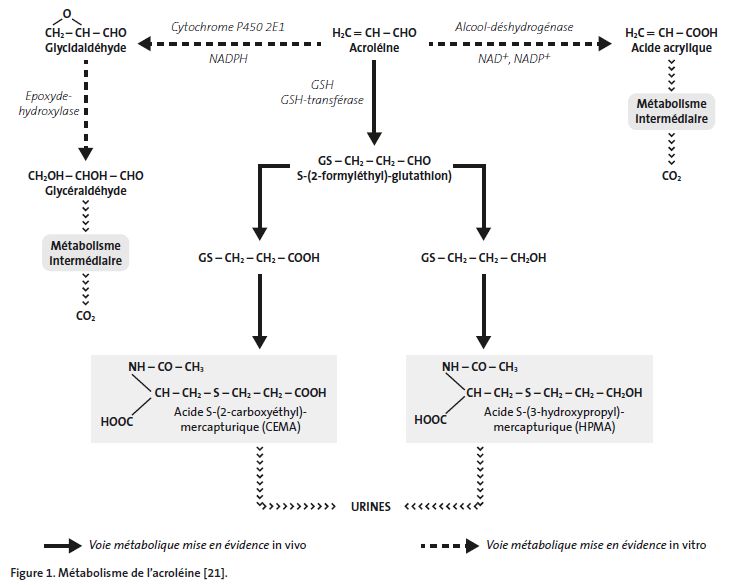
Excrétion
Chez le rat, après administration orale de 14C-acroléine (2,5 mg/kg), l'élimination de molécules radiomarquées est de 52 à 63 % dans l'urine, de 12 à 15 % dans les fèces et de 27 à 31 % sous forme de CO2 dans l'air expiré[18]. Après administration d'une plus forte dose (15 mg/kg), la quantité éliminée diminue dans les urines et augmente dans les fèces.
Les métabolites urinaires identifiés comprennent les dérivés mercapturiques, l'acide 3-hydroxypropionique, l'acide malonique et l'acide oxalique ; le HPMA étant le métabolite le plus abondant et le CEMA représentant moins de 10 % des acides mercapturiques excrétés [22]. Le pic d'excrétion des métabolites se situe dans les 5 premières heures après l'exposition.
La nature des métabolites fécaux n'est pas connue, il s'agirait de polymères d'acroléine ou d'adduits polysaccharidiques ou protéiniques résultant de la réaction de l'acroléine avec les composés de la nourriture dans le tractus gastro-intestinal[19].
Chez l'Homme
Aucune donnée n'est disponible chez l'homme à la date de publication de cette fiche.
Surveillance Biologique de l'exposition
L’effet critique de l’acroléine étant l’irritation des voies respiratoires et de la muqueuse oculaire, la surveillance biologique de l’exposition n’est pas pertinente.
La Commission allemande DFG a toutefois proposé le dosage de l'acide S-(3-hydroxypropyl)mercapturique (HPMA) urinaire en fin de poste, après plusieurs postes, pour lequel une valeur BAR de 600 µg/g de créatinine a été établie chez les non-fumeurs (correspondant au 95e percentile des valeurs retrouvées chez les non-fumeurs en population générale) [23].
-
Mode d'actions [24]
L'acroléine est un aldéhyde fortement réactif avec les composants cellulaires, principalement avec les groupements thiols du glutathion et des protéines, et avec les amines primaires et secondaires ; elle rompt l'équilibre en groupements thiols des cellules cibles, dénature les protéines et interfère avec la synthèse des acides nucléiques. Bien que de nombreuses molécules réagissent dans les conditions physiologiques avec l'acroléine, le produit de réaction le plus important provient de l'addition nucléophile sur le carbone éthylénique terminal avec pour conséquence, entre autres, une déplétion en glutathion cellulaire et une inhibition des enzymes contenant des groupements -SH (thiols) dans leur site actif. Le glycidaldéhyde, formé in vitro par action des enzymes microsomiales, est un mutagène et un cancérogène connu ; il n'a pu être mis en évidence in vivo.
La coexposition avec du glutathion ou un autre composé contenant des groupements -SH protège contre les effets biologiques de l'acroléine et, inversement, une déplétion en glutathion, provoquée par un autre xénobiotique par exemple, augmente la toxicité de l'acroléine.
-
Toxicité expérimentale
Toxicité aiguë [20, 24]
La toxicité aiguë de l’acroléine est très élevée. À la suite d’une exposition par inhalation, les symptômes observés comprennent une irritation des voies respiratoires et du système gastro-intestinal ainsi qu’une dépression du système nerveux central.
Par voie orale, une hausse de la mortalité est rapportée ; des lésions sont observées au niveau du foie et de l’estomac. L’acroléine est fortement irritante pour toutes les muqueuses ; administrée pure, elle est caustique. Aucun potentiel sensibilisant n’est rapporté.
L'acroléine est une substance très toxique par inhalation et toxique par voie orale. Les CL50 sont de 18 - 21 mg/m3/4 h chez le rat et de 151 mg/m3/6 h chez la souris ; par voie orale, la DL50 est de 42 - 46 mg/kg chez le rat et de 28 mg/kg chez la souris. La DL50 cutanée est de 562 mg/kg chez le lapin.
L'inhalation de fortes concentrations provoque, chez le rat, des perturbations de la coordination motrice, des convulsions (> 1214 mg/m3), une augmentation de la pression sanguine et une baisse de la fréquence cardiaque (2500 à 5000 mg/m3), une cyanose des extrémités (> 22 900 mg/m3) et une asphyxie.
Pour des concentrations plus faibles, l'acroléine n'induit que des effets locaux sur les voies respiratoires et les yeux. Une détresse respiratoire et une irritation nasale ont été montrées chez le rat et la souris à partir de 25 mg/m3 pendant 4 heures. Les modifications histopathologiques se situent au niveau de la cavité nasale avec un gradient de sévérité antéropostérieur :
- dégénérescence de l'épithélium respiratoire avec perte de cils, exfoliation, nécrose, sécrétion muqueuse et vacuolisation,
- modification inflammatoire aiguë avec infiltration de leucocytes dans la muqueuse, hyperémie, hémorragie et œdème intercellulaire.
Des modifications prolifératives de l'épithélium respiratoire (stratification précoce et hyperplasie) sont observées chez le hamster, après une exposition à 13,7 mg/m3 d'acroléine pendant 4 heures [25].
La RD50 (dose inhibant la fréquence respiratoire de 50 %) est de 2,4 à 6,8 mg/m3 chez la souris et de 11 à 21 mg/m3 chez le rat. La fréquence respiratoire revient à la normale dans les 10 minutes [26].
Plusieurs indicateurs de stress oxydant ont été observés chez des rats exposés pendant 4 heures à 2,3 mg/m3 d'acroléine : diminution des niveaux pulmonaires en acide ascorbique, glutathion, lactase, lactase déshydrogénase ou glutathion peroxydase, entre autres [19].
Les lésions des cellules épithéliales du tractus respiratoire et l'inhibition de la fonction phagocytaire des macrophages seraient responsables d'une moindre résistance à l'infection bactérienne observée chez la souris (3 et 6 ppm (7 et 14 mg/m3), 8 h) [19].
Par voie orale, l'administration d'une dose unique de 25 mg/kg pc d'acroléine, par voie intra-gastrique chez le rat mâle, entraîne une hausse de la mortalité et des lésions dégénératives du foie (dégénérescence éosinophile), du préestomac et de l'estomac glandulaire (inflammation sévère avec œdème et infiltration de leucocytes, gastrite hémorragique, ulcérations multifocales, dépôts de fibrine). Aucun changement histopathologique n'a été observé dans la vessie, les poumons, les reins ou la rate [27].
Irritation, sensibilisation
L'acroléine est très irritante, même en solution diluée ; une solution à 1 % provoque un érythème cutané avec formation d'œdème et des lésions oculaires (œdème de la conjonctive) chez le lapin [28]. La substance pure n'a pas été testée et est considérée comme caustique.
Elle n'est pas sensibilisante pour le cobaye dans le test de Magnusson et Kligmann [29].
Toxicité subchronique, chronique
À la suite d’expositions répétées à l’acroléine, on observe une réduction du poids corporel, des modifications histopathologiques du nez, des voies respiratoires supérieures et des poumons (inflammation, hémorragie, métaplasie, hyperplasie, œdème). La sévérité des effets respiratoires s’accroît avec la concentration en acroléine.
Par voie orale, l’estomac est le principal organe atteint.
En exposition subaiguë, chez la souris (3,9 mg/m3, 6 h/j, 5 jours) et chez le rat (0,13 - 1,3 - 16,8 mg/m3, 6 h/j, 5 j/sem, 3 semaines), les modifications sont localisées dans la cavité nasale : métaplasie, hyperplasie et dysplasie sévères de l'épithélium respiratoire, modérées de l'épithélium olfactif et nulles de l'épithélium squameux. Chez le rat, la concentration sans effet observé (NOEC) est de 1,3 mg/m3 (6 h/j, 5 j/sem, 3 semaines)[21].
De nombreuses études sont disponibles, au cours desquelles plusieurs espèces ont été exposées par voie respiratoire (rat, souris, chien, singe, cobaye). Chez toutes ces espèces, l'organe cible est l'appareil respiratoire mais leur sensibilité diffère, le rat apparaissant comme l'espèce la plus sensible [4].
Des rats ont été exposés à des concentrations en acroléine comprises entre 0,047 et 11,5 mg/m3, pendant 6 à 13 semaines, dans plusieurs études [4, 30 à 32]. Les effets suivants ont été rapportés :
- pour des concentrations inférieures à 0,5 mg/m3, diminution du poids corporel,
- de 0,5 à 1,5 mg/m3, modifications histopathologiques inflammatoires localisées au niveau des cavités nasales, métaplasie et hyperplasie nasales, métaplasie au niveau du larynx,
- de 1,5 à 4,2 mg/m3, modifications histopathologiques inflammatoires au niveau du nez et du larynx, dégénérescence et atrophie de l'épithélium olfactif avec perte de neurones olfactifs, métaplasie squameuse de l'ensemble de l'appareil respiratoire, fibrose pulmonaire, hémorragie pulmonaire,
- de 4,2 à 11,5 mg/m3, décès, lésions nasales (rhinite nécrosante, métaplasie, infiltration neutrophilique), laryngées (métaplasie), trachéales (métaplasie et hyperplasie), broncho-pulmonaires (nécrose, desquamation, œdème, métaplasie et hyperplasie, hémorragie, pneumopathie).
Aux plus fortes doses, une augmentation du poids des reins, du foie, du cœur et du cerveau est aussi observée (aucune précision n'est donnée sur d'éventuelles lésions histopathologiques associées).
Des souris exposées à 7 mg/m3 d'acroléine pendant 3 semaines (6 h/j, 5 j/sem) présentent une augmentation significative et persistante des macrophages dans le liquide de lavage bronchoalvéolaire, associée à une hypersécrétion de mucus [4]. À la suite d'une administration intranasale de 1 ou 5 µmol/kg pc/j d'acroléine (5 j/sem, 4 sem), une inflammation pulmonaire importante est observée chez les souris, avec gonflement des alvéoles, infiltration de macrophages et augmentation des niveaux en cytokines et en facteurs pro-inflammatoires dans le parenchyme pulmonaire [33].
Par voie orale (gavage), des souris et des rats ont été exposés respectivement à 1,25 - 2,5 - 5 - 10 - 20 mg/kg pc/j ou 0,75 - 1,25 - 2,5 - 5 - 10 mg/kg pc/j, pendant 13 semaines [34]. Une augmentation, liée à la dose, de la fréquence des lésions histopathologiques de l'estomac (hémorragie, nécrose et inflammation de l'estomac glandulaire et du préestomac, hyperplasie épithéliale squameuse du préestomac) est observée chez les rats à partir de 1,25 mg/kg pc/j et chez les souris pour toutes les doses. Une augmentation du poids du foie (rats et souris) et des reins (souris seulement) est aussi rapportée aux doses supérieures à 2,5 mg/kg pc/j (aucune précision n'est donnée sur d'éventuelles lésions histopathologiques associées).
À partir de 0,5 mg/kg pc/j d'acroléine, administrée par gavage pendant 2 ans, une augmentation de la mortalité liée à la dose est observée chez les rats [35]. Chez la souris, la mortalité est significativement plus élevée à la plus forte dose administrée pendant 18 mois, par gavage (4,5 mg/kg pc/j) [36].
Effets génotoxiques
L’acroléine est difficile à tester en mutagenèse du fait de sa grande réactivité qui l’empêche d’atteindre sa cible et d’une forte cytotoxicité qui gêne l’expression de la mutation. In vitro, l’acroléine induit des résultats positifs au test d’Ames (sans activation métabolique) et est à l’origine d’échanges de chromatides sœurs, de cassures simple-brin et d’adduits à l’ADN, dans les cellules de mammifères. Aucun effet génotoxique n’est rapporté in vivo.
In vitro
In vitro, l'acroléine est un mutagène faible, en l'absence d'activation métabolique, dans les tests bactériens utilisant S. typhimurium TA100, TA104, TA98 (10 - 56 µg/mL) et dans les cellules V79 de hamster syrien (à concentration cytotoxique) ; elle est non mutagène en présence d'activation métabolique [19].
L'acroléine induit :
- des échanges entre chromatides sœurs en absence d'activation métabolique à partir de 56 µg/L mais pas d'aberration chromosomique, dans les cellules ovariennes de hamster chinois et les lymphocytes humains en culture[20, 28] ;
- des cassures simple-brin dans des hépatocytes de rats et des lymphocytes humains (à des concentrations cytotoxiques) [20] ;
- des liaisons croisées ADN-protéines dans les cellules de la muqueuse respiratoire nasale de rat (4,6 mg/m3, pendant 6 heures) [20] et les cellules de lymphomes humains (> 150 µM)[37].
- l'acroléine ne provoque pas la transformation de cellules embryonnaires, mais initie le processus qui est révélé par l'exposition des cellules à un promoteur (ester de phorbol) [20].
In vivo
In vivo, par voie orale, elle n'induit pas de létalité récessive liée au sexe chez la drosophile adulte ou au stade larvaire. Elle ne provoque pas d'aberration chromosomique dans la moelle osseuse du rat (1 - 2,1 - 4,1 mg/kg, voie intrapéritonéale) ni de létalité dominante chez la souris (1,5 ou 2,2 mg/kg, voie intrapéritonéale) [28].
Selon l'US EPA, l'acroléine est fortement cytotoxique et mutagène dans quelques systèmes d'essai. La sensibilité aux effets mutagènes est augmentée par les agents diminuant les stocks de glutathion et diminuée par l'activation métabolique, indiquant que l'acroléine est un génotoxique direct. Bien que l'acroléine soit capable d'alkyler l’ADN et l'acide ribonucléique (ARN) et d'inhiber l'activité des méthylases de l’ADN dans le foie et la vessie, in vivo l'acroléine pourrait ne jamais atteindre les tissus cibles chez les animaux du fait de sa forte réactivité [38].
Effets cancérogènes
Même si les quelques études disponibles ayant évalué le potentiel cancérogène de l’acroléine possèdent des limitations méthodologiques qui rendent difficile leur interprétation (nombre d’animaux trop faible, durée d’exposition trop courte, pureté et stabilité des solutions inconnues...), il semble que l’acroléine ne soit pas cancérogène.
L'acroléine n'est pas cancérogène par voie cutanée chez la souris (0,5 % dans l'acétone, 1 fois/sem, 10 semaines ou 12,6 mg/animal au total), par inhalation chez le rat (18,3 mg/m3, 1 h/j, 5 j/sem, 52 semaines) et le hamster (9,2 mg/m3, 7 h/j, 5 j/sem, 52 semaines), ou par voie orale chez le rat (0,05 - 0,5 - 2,05 mg/kg/j, 12 ou 24 mois) et la souris (0,5 - 2 - 4,5 mg/kg/j, 18 mois) [20, 38]. Toutefois, il faut noter que la durée de ces études n'est pas assez longue pour évaluer le potentiel cancérogène de l'acroléine.
Le seul effet observé est une augmentation de l'incidence des adénomes du cortex surrénalien chez le rat femelle exposé à 12,5 mg/j (5 j/sem, 100 semaines, dans l'eau de boisson) [38].
L'injection d'acroléine par voie intrapéritonéale (2 mg/kg, 2 fois/sem, 6 semaines) chez le rat n'entraîne aucune augmentation de l'incidence des tumeurs. En revanche, lorsque l'injection d'acroléine est suivie par un traitement par l'uracile à 3 % dans la nourriture pendant 20 semaines, une induction de tumeurs de la vessie est observée (papillomes chez 60 % des animaux) : d'après ces données, les auteurs suggèrent que l'acroléine est un initiateur de tumeurs de la vessie[39].
Même si les données disponibles actuellement sont insuffisantes pour conclure quant à la cancérogénicité de l'acroléine, il est important de noter que l'acroléine en tant que composant de la fumée de cigarettes pourrait jouer un rôle dans la survenue de cancers pulmonaires, en combinaison avec d'autres cancérogènes [4]. Une étude récente met en évidence l'implication de l'acroléine dans des mutations géniques observées dans certains cancers pulmonaires induits par le tabac[40].
Effets sur la reproduction
L’acroléine, par voie générale, n’agit ni sur la fertilité ni sur le développement des fœtus à des doses non toxiques pour les mères.
Fertilité
Une étude sur deux générations chez le rat (0 - 1 - 3 - 6 mg/kg/j par gavage, pendant 70 jours avant l'accouplement et 21 jours après) a été réalisée : aucun paramètre lié à la reproduction n'est modifié chez les animaux de la génération F0 [41]. Chez les fœtus, une diminution du poids corporel est observée à la plus forte dose, en lien avec la perte de poids des mères.
Développement [20, 28, 38]
La dose sans effet observé sur le développement du lapin est de 2 mg/kg/j par gavage (traitement du 7ième au 19ième jour de gestation).
Du fait de sa grande réactivité locale, l'acroléine ne peut atteindre sa cible par voie générale ; elle induit des effets embryotoxiques et tératogènes si elle est administrée directement au contact de l'embryon ou du fœtus.
-
Toxicité sur l’Homme
L’acroléine sous forme de liquide, vapeurs ou aérosols est fortement irritante pour les muqueuses respiratoire et oculaire ainsi que pour la peau. Il n’y a pas de donnée sur les effets d’une exposition chronique à cette substance.
Toxicité aiguë [1, 19, 24, 42]
L’effet critique de l'acroléine est l'irritation des voies respiratoires et de la muqueuse oculaire.
L'exposition par voie respiratoire peut entraîner des signes d'irritation des yeux, du nez et de la gorge, une toux, une dyspnée, un bronchospasme, un œdème pulmonaire de survenue retardée.
Une publication ancienne rapporte un cas de décès après inhalation d'acroléine. Il s'agit de deux enfants de 2 et 4 ans exposés pendant 2 heures à des fumées de friteuse surchauffée dont le plus jeune décède 24 heures après dans un tableau d'asphyxie. La responsabilité de l'acroléine est évoquée mais d'autres composants des fumées peuvent avoir contribué à la symptomatologie.
Un tableau de pneumopathie chimique avec dyspnée, sensation de constriction thoracique, toux, expectoration spumeuse, cyanose, fièvre, de survenue retardée (environ 20 heures après l'exposition) est décrit chez un employé d'une usine de produits chimiques exposé accidentellement par voie respiratoire (inhalation de vapeurs d'acroléine) et cutanée (projection au niveau du visage). Dix-huit mois après l'exposition, une discrète dyspnée d'effort persiste, associée à des crises de dyspnée paroxystiques. Les auteurs concluent à une insuffisance respiratoire débutante avec une légère désaturation oxyhémoglobinée au repos et un volume résiduel un peu augmenté aux EFR (explorations fonctionnelles respiratoires) [43]. Aucune information n'est donnée concernant une éventuelle pathologie pulmonaire préexistante ou un tabagisme pouvant impacter le diagnostic.
Des volontaires exposés à une concentration d'acroléine croissante de 0 à 0,6 ppm pendant 35 minutes, puis constante à 0,6 ppm pendant 5 minutes, rapportent une légère irritation oculaire à 0,09 ppm, une irritation nasale à 0,15 ppm et une irritation de la gorge à 0,43 ppm. Une augmentation de la fréquence de clignement oculaire et une diminution de la fréquence respiratoire (de 25 % en moyenne) sont observées à 0,26 et 0,6 ppm respectivement. Dans la même étude, lors d'une exposition constante à 0,3 ppm pendant 60 minutes, l'irritation des yeux, du nez et de la gorge augmente avec la durée d'exposition, puis demeure constante après les 40 premières minutes. Une diminution de 20 % de la fréquence respiratoire est également notée.
Par ailleurs, certains auteurs suggèrent que l'exposition environnementale à l'acroléine pourrait constituer un facteur de risque d'irritation des voies respiratoires parmi la population générale d'adultes (augmentation de la prévalence des crises d'asthme) [44].
Une blépharo-conjonctivite, un œdème des paupières, des sécrétions fibrineuses ou purulentes et des lésions cornéennes possiblement prolongées sont décrits après projection oculaire d'acroléine sous forme liquide[45].
L'application cutanée d'une solution de 10 % d'acroléine dans l'éthanol chez des volontaires entraîne une irritation sévère avec lésions bulleuses et nécrose épidermique à l'examen histologique (biopsie cutanée à 48 heures).
En cas d'ingestion, une irritation sévère du tractus gastrointestinal peut être observée.
Toxicité chronique
Aucune donnée n'est disponible chez l'homme à la date de parution de la fiche.
Effets génotoxiques
Aucune donnée n'est disponible chez l'homme à la date de parution de la fiche.
Effets cancérogènes [478]
Il n'y a pas de données pertinentes permettant d'évaluer la cancérogénicité de l'acroléine chez l'homme.
Effets sur la reproduction
Aucune donnée n'est disponible chez l'homme à la date de parution de la fiche.
-
Interférences métaboliques
-
Cohérence des réponses biologiques chez l'homme et l'animal
