Pathologie - Toxicologie
-
Toxicocinétique - Métabolisme [1, 2, 5, 7]
Le trichloroéthylène est rapidement absorbé quelle que soit la voie d'exposition. Après absorption, il est largement distribué dans tout l'organisme, en particulier dans les tissus adipeux. Il est éliminé, soit sous forme inchangée dans l'air expiré, soit sous forme métabolisée dans les urines ou dans la bile, et ce de façon similaire dans toutes les espèces (avec des différences de saturabilité enzymatique).
Chez l'animal
Absorption
Chez l’animal, le trichloroéthylène (TCE) est rapidement absorbé par voie inhalée (90% dans les 5 premières minutes, exposition à 50 ou 500 ppm pendant 2 h). L’équilibre sanguin est atteint après 30 minutes dans le cas d'une exposition à 50 ppm ; au contraire, chez des rats exposés à 500 ppm, l’équilibre sanguin n’est toujours pas atteint 2 heures après l’exposition [27]. Le pourcentage d’absorption de TCE par voie pulmonaire est fonction de la durée d’exposition.
L’absorption gastro-intestinale est rapide et peut atteindre 90% de la dose ingérée : elle est influencée par la prise d’aliments et le véhicule d’administration.
L’absorption cutanée de vapeur est négligeable ; l’absorption de liquide, pur ou dilué, déposé sur la peau est plus importante. Le taux d’absorption est d’environ 8 µg/cm2/min chez la souris suite à l’application de 0,5 mL de trichloroéthylène pur sur de la peau rasée pendant 15 minutes.
Distribution
Après absorption, le trichloroéthylène est largement distribué dans tout l’organisme, avec des niveaux particulièrement élevés dans le tissu adipeux, le foie, les reins et le cerveau ; il passe les barrières méningée et placentaire et est retrouvé dans le lait maternel.
Métabolisme
Chez l’animal le trichloroéthylène est rapidement métabolisé, surtout dans le foie, par deux voies : une voie oxydative par l’intermédiaire des monooxygénases à cytochrome P450, probablement le CYP2E1, et une voie qui implique la conjugaison avec le glutathion (fig. 1 et 2).
Qualitativement, le métabolisme est similaire entre toutes les espèces. Trois métabolites urinaires majeurs ont été identifiés, représentant 90% des métabolites urinaires chez le rat : le trichloroéthanol, son conjugué à l’acide glucuronique et l’acide trichloroacétique ainsi que quelques métabolites mineurs tels que la 2-(hydroxyacétyl)éthanolamine, l’acide oxalique et l’acide dichloroacétique [28]. De faibles quantités de S-1,2-dichlorovinylglutathion (1,2-DCVG) ont été détectées dans la bile et le sang chez le rat.
Des différences quantitatives dans le métabolisme du TCE, existent entre les espèces :
- chez la souris, la saturation du métabolisme du trichloréthylène se produit à des doses plus élevées que chez le rat après une exposition par voie respiratoire (doses supérieures à 600 ppm/6 h), la part de trichloroéthylène métabolisée est indépendante de la dose administrée (97 - 99 % d’une dose de 10 ou 600 ppm par inhalation, pendant 6 h) ; par voie orale, le pic sanguin des métabolites est atteint en 2 heures ;
- chez le rat, le métabolisme est fonction de la dose administrée par inhalation (98% d’une dose de 10 ppm et 79% de 600 ppm, pendant 6 h) ; le trichloroéthylène inchangé est éliminé dans l’air expiré. Par voie orale, il existe aussi une saturation métabolique qui entraîne des concentrations sanguines de trichloroéthanol et d’acide trichloroacétique 4 à 7 fois moins importantes que chez la souris. Le pic sanguin des métabolites est atteint en 10-12 heures [29].
La voie métabolique dépendante du glutathion apparait mineure dans le métabolisme du trichloroéthylène, mais elle peut aboutir à une bioactivation et conduire à des effets toxiques.
Schéma métabolique
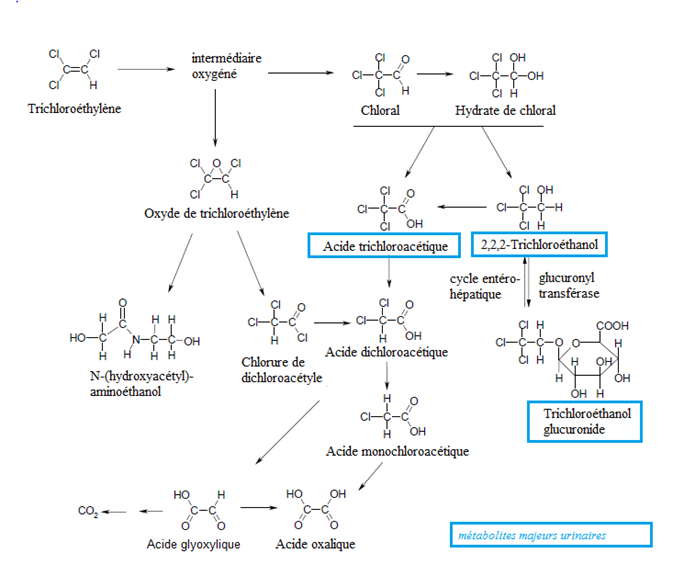
Fig.1 Voie proposée dépendante du cytochrome P450 [1]
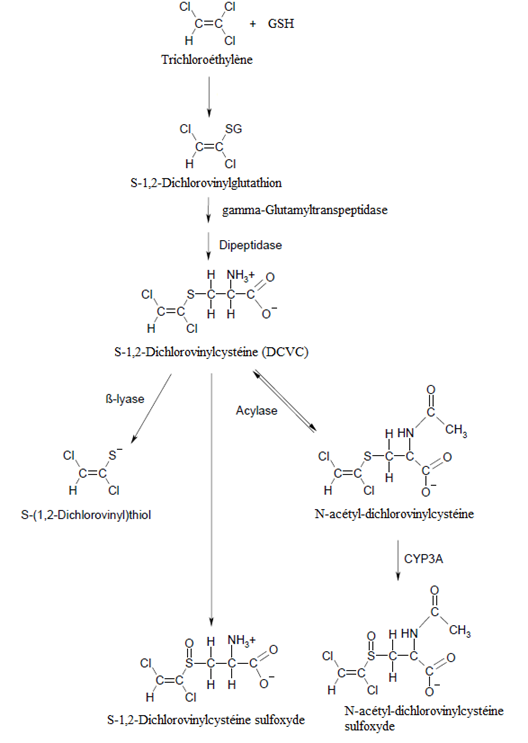
Fig.2 Voie proposée dépendante du glutathion[1]
Excrétion
Les voies d’élimination du trichloroéthylène sont identiques chez l’animal et l’Homme, sans influence de la voie d’exposition. Le trichloroéthylène non métabolisé et les métabolites volatils (CO2, CO, trichloroéthanol) sont éliminés dans l’air expiré ; les autres métabolites sont principalement éliminés via les urines. Il existe également une excrétion biliaire mineure.
La vitesse d’élimination diffère selon les métabolites : le chloral et le trichloroéthanol sont éliminés avec une demi-vie plasmatique de 1 à 2 heures alors que l’acide trichloroacétique subsiste à fortes concentrations pendant 30 heures et est ensuite éliminé dans les 48 heures suivantes.
Lors d’études par gavage chez le rat, les métabolites principaux, trichloroéthanol libre ou conjugué (12 et 62%) et acide trichloroacétique (15%), sont éliminés dans l’urine et dans les fèces ; les métabolites mineurs (< 10 % des métabolites totaux urinaires, acides dichloroacétique et monochloracétique, N-(hydroxyacétyl)aminoéthanol et N-acétyldichlorovinylcystéine) sont éliminés dans l’urine.
Intéraction
L’éthanol potentialise l’action du trichloroéthylène en utilisant les monooxygénases pour son propre métabolisme. Il s’ensuit une concentration sanguine et pulmonaire de trichloroéthylène plus élevée et une baisse des métabolites urinaires [5].
Chez l'Homme
Chez l’Homme, l’absorption pulmonaire est initialement très rapide et l’équilibre sanguin est atteint après environ 1 heure (exposition à 100 ppm pendant 4 h)[30]. La dose absorbée (37 à 64%) est proportionnelle à la concentration inhalée, à la durée de l’exposition et au taux de ventilation alvéolaire ; elle diminue avec l’exercice physique et est approximativement divisée par 2 si on passe du repos à un travail d’une intensité de 150 W (l'air dans les alvéoles se renouvelle plus vite que le produit ne diffuse à travers la paroi alvéolaire).
L’absorption gastro-intestinale n’a pas été quantifiée chez l’Homme mais des cas d’empoisonnement rapportés dans la littérature indiquent qu’elle est rapide et importante.
La mesure de l’absorption cutanée est compliquée par le fait que le trichloroéthylène est un solvant lipophile qui dégraisse la peau et attaque le stratum corneum, augmentant sa propre absorption. Que cela soit suite à une exposition à des vapeurs ou au liquide lui-même, le trichloroéthylène est rapidement détecté dans l’air exhalé des volontaires exposés (entre 1 à 5 minutes après le début du contact d’une main immergée dans une solution de TCE de concentration inconnue) [30].
Après absorption, le trichloroéthylène est largement distribué dans l’organisme via la circulation sanguine ; il passe les barrières méningée et placentaire. De par sa forte liposolubilité, les concentrations les plus importantes sont retrouvées dans le tissu adipeux, le foie, le cerveau et les reins.
Qualitativement, le métabolisme est similaire entre toutes les espèces, y compris l’Homme, et se déroule principalement au niveau du foie, sous l’action de cytochromes P450 (la voie métabolique dépendante du glutathion est mineure). Trois métabolites urinaires majeurs ont été identifiés : le trichloroéthanol, son conjugué à l’acide glucuronique et l’acide trichloroacétique ainsi que quelques métabolites mineurs tels que la 2-(hydroxyacétyl)éthanolamine, l’acide oxalique, l’acide monochloroacétique et l’acide dichloroacétique.
Chez l’Homme, aucune saturation métabolique n’a pu être montrée aux concentrations d’exposition expérimentales (jusqu’à 315 ppm pendant 3 h) ; le pourcentage métabolisé est compris entre 40 et 75% de la dose absorbée, suite à une exposition pendant 3 à 8 h à des vapeurs de trichloroéthylène de 50 à 350 ppm [1].
Comme chez l’animal, le trichloroéthylène non métabolisé (10 à 28% de la dose) et les métabolites volatils (CO2, CO, trichloroéthanol) sont éliminés dans l’air expiré ; les métabolites principaux sont éliminés principalement dans les urines et, dans une moindre mesure, dans les fèces [5].
Le trichloroéthanol atteint sa concentration maximale dans le sang et l’urine presque immédiatement après l’exposition, puis la concentration diminue avec une demi-vie d’élimination urinaire d’environ 10 h, élimination qui semble plus rapide chez l’homme que chez la femme. L’élimination rénale du TCA est plus lente du fait de sa forte liaison aux protéines plasmatiques (demi-vie d’élimination urinaire d’environ 50 heures) et serait plus importante chez les femmes que chez les hommes[2].
Surveillance Biologique de l'exposition
Plusieurs indicateurs biologiques d’exposition ont été proposés pour la surveillance biologique de l’exposition au trichloroéthylène.
Le dosage du trichloroéthylène (TCE) dans les urines en fin de poste est un indicateur spécifique qui paraît bien corrélé avec les concentrations atmosphériques de trichloroéthylène.
Les dosages d'acide trichloroacétique (TCA) et de trichloroéthanol (TCOH) urinaires en fin de poste et fin de semaine de travail sont également bien corrélés avec les concentrations atmosphériques de trichloroéthylène. La concentration urinaire de TCA reflète l’exposition de la semaine précédente, celle de TCOH est le reflet de l’exposition du jour même et de la veille. Ces métabolites ne sont pas spécifiques (métabolites communs au 1,1,1-trichloroéthane, tétrachloroéthane, tétrachloroéthylène).
Les dosages de trichloroéthylène dans le sang et dans l’air exhalé en fin de poste, indicateurs spécifiques, ont été proposés pour confirmer une exposition, par exemple en cas de doute sur la nature des dérivés chlorés. Il n’y a pas de donnée sur une éventuelle corrélation entre concentrations sanguines et atmosphériques de TCE. Le dosage du TCE dans l’air exhalé présente des inconvénients liés aux difficultés de prélèvement ainsi qu’une grande variabilité individuelle. De plus, en raison de la diminution rapide de la concentration dans l’air exhalé dans les premières minutes après l’arrêt de l’exposition, le moment de prélèvement en fin d’exposition doit être strictement respecté.
Les dosages sanguins du TCA et du TCOH ne présentent pas d’avantage par rapport aux dosages urinaires correspondants.
Le dosage de la N-acétyl-dichlorovinylcystéine (N-acétyl-DCVC) urinaire, issue de la voie métabolique impliquée dans la néphrotoxicité du TCE, semble être un indicateur intéressant mais les données disponibles sont limitées.
Des valeurs limites biologiques (VLB) pragmatiques sont proposées par l’Anses pour le TCE, le TCA et le TCOH urinaires, sur la base de la relation avec la VLEP-8h de 40 mg/m3 (soit 7 ppm) proposée par l’Anses (valeurs non validées, en cours de consultation). Des valeurs biologiques de référence (VBR) correspondant au 95e percentile des valeurs retrouvées dans des groupes de sujets adultes de la population générale, sont proposées par l’Anses pour le TCE et le TCA urinaires (valeurs non validées, en cours de consultation).
D’autres organismes proposent également des valeurs biologiques d’interprétation (VBI) pour le milieu de travail pour le TCA urinaire et le TCOH sanguin [31].
Les valeurs BEI de l'ACGIH pour le TCE dans le sang et l’air exhalé en fin de poste, sans valeur définie, sont accompagnées d'une notation SQ "semi quantitative".
-
Mode d'actions
-
Toxicité expérimentale
Toxicité aiguë [4]
Le principal effet toxique aigu du trichloroéthylène est une dépression du système nerveux central avec narcose à forte dose. C'est un irritant de la peau et des yeux et un sensibilisant cutané.
Le trichloroéthylène présente une faible toxicité aiguë. La CL50 est de 12 000 ppm/4 h (65 mg/L/4 h) chez le rat et 8450 ppm/4 h (46 mg/L/4 h) chez la souris. Par voie orale, la DL50 est de 5400 - 7200 mg/kg chez le rat et 2900 mg/kg chez la souris ; par voie cutanée, la DL50 est > 20 000 mg/kg chez le lapin (sous pansement occlusif) et > 7800 mg/kg chez le cobaye.
Les principaux symptômes, après exposition orale ou inhalatoire, sont ceux d’une dépression du système nerveux central (somnolence, faible coordination, anesthésie et arrêt respiratoire) associés à une irritation des yeux et du tractus respiratoire en cas d’exposition par inhalation.
L’anesthésie est complète après 4 heures d’exposition à 5000 ppm, correspondant à une concentration sanguine en trichloroéthylène > 100 µg/mL. Un prétraitement à l’éthanol potentialise ces effets. La dose sans effet sur le système nerveux central, chez le rat et la souris, est 500 ppm pendant 4 heures.
Un effet hépatique est mis en évidence par une augmentation transitoire des enzymes sériques, alanine aminotransférase et aspartate aminotransférase, et une augmentation de poids du foie par infiltration graisseuse (> 800 ppm, 3 heures, rat et souris, ou > 700 mg/kg par voie orale, souris). De fortes concentrations (lapin : jusqu’à 6000 ppm/1 h, rat : 25 000 ppm/1 h) induisent une hypersensibilité cardiaque aux catécholamines qui se traduit par des arythmies. Cet effet est potentialisé par l’éthanol [32, 33].
Des atteintes spécifiques de l'espèce sont liées au métabolisme :
- néphrotoxicité transitoire qui s’exprime, chez le rat uniquement, quand le métabolisme est saturé (1000 et 2000 ppm, 6 h)[2];
- toxicité pulmonaire qui apparaît, chez la souris uniquement, après exposition par inhalation (exposition unique au-dessus de 20 ppm pendant 6 heures ou au-dessus de 500 ppm pendant 30 minutes), réversible en 7 jours ; elle est limitée à un seul type cellulaire, les cellules de Clara, et serait liée à l’accumulation d’hydrate de chloral, métabolite intermédiaire du trichloroéthylène, que ces cellules ne peuvent pas métaboliser [34].
Irritation, sensibilisation [4]
Une seule étude est disponible chez le cobaye dans laquelle le trichloroéthylène semble être un irritant cutané fort : suite à l’application de 0,1 mL de substance pure (3 fois/jour, pendant 3 jours), érythème et œdème apparaissent après 24 heures, accompagnés de crevasses, de gerçures et d’une augmentation de l’épaisseur de la peau jusqu’à 200 % après 7 jours [35].
Instillé dans l’œil du lapin (0,1 mL de substance pure), il provoque une conjonctivite légère à modérée réversible en 14 jours avec apparition de kératose épithéliale lors de la guérison. L’exposition à des vapeurs de TCE (376 ppm, 4 h/j, 5 j/sem, pendant 1 à 2 semaines) entraîne une irritation oculaire chez le rat [1].
Les tests réalisés chez le cochon d'Inde (GPMT) et la souris (LLNA) ont mis en évidence une sensibilisation cutanée avec le trichloroéthylène et deux de ses métabolites, l'acide trichloroacétique et le dinitro-2,4 chlorobenzène[13].
Toxicité subchronique, chronique
Les principaux effets toxiques (hors neurotoxicité), après expositions répétées par inhalation ou par voie orale, sont observés au niveau du foie, des reins et du système immunitaire. Des effets pulmonaires et auditifs ont aussi été rapportés par inhalation.
Les animaux survivent à des expositions de 1000 à 7000 ppm pendant 90 jours.
- Effets pulmonaires : les effets pulmonaires (vacuolisation des cellules de Clara) apparaissent uniquement chez la souris (450 ppm, 6 h/j, 5 j/sem pendant 2 semaines). Ils sont réversibles, disparaissent après les 5 premiers jours d’exposition et réapparaissent lors de l’exposition suivante, après 2 jours de pause [34]. Chez le rat, les effets suivants ont été rapportés suite à une exposition à des vapeurs pendant 90 jours (376 ppm, 4h/j, 5 j/sem) : bronchiolite, alvéolite, œdème, changements de type emphysémateux[1].
- Effets hépatiques : des modifications hépatiques sont observées dans certaines études chez le rat et la souris, à partir de 37 ppm en exposition continue pendant 30 jours : augmentation du poids relatif réversible, augmentation d’activité des monooxygénases à cytochrome P450 et des enzymes sériques marqueurs de dysfonctionnement hépatique, infiltration graisseuse, hépatomégalie et, à très fortes concentrations, nécrose centrolobulaire. La souris est plus sensible que le rat. Dans les études par voie orale, une prolifération des peroxysomes a été montrée dans le foie de la souris mais pas dans celui du rat. La plupart des effets observés, lors d’expositions à des concentrations inférieures à 800 ppm, sont réversibles et correspondraient à une adaptation à l’amplification du métabolisme.
- Effets rénaux : la toxicité rénale est caractérisée par une augmentation du poids des reins (à partir de 75 ppm chez les mâles et 150 ppm chez les femelles, 6 h/j, 5 j/sem, 4 sem), des lésions tubulaires (à partir de 800 ppm, 12 semaines : cytomégalie et dilatation, modifications biochimiques indicatives de dysfonctionnement du tube proximal) et une méganucléocytose chez le rat mâle uniquement (à partir de 300 ppm, 7 h/j, 5 j/sem, 104 sem, [2]).
Des effets similaires sont observés suite à une exposition par voie orale [2] :
- nucléocytose tubulaire chez des rats exposés à 250 mg/kg pc/j (gavage dans de l’huile d’olive pendant 52 semaines, NOAEL 50 mg/kg pc/j);
- lésions dégénératives de l’épithélium tubulaire chez des rats mâles et femelles exposés à 550 et 1100 mg/kg pc/j ainsi que chez la souris à 1200 et à 2300 mg/kg pc/j (gavage dans de l’huile pendant 78 semaines) ;
- cytomégalie des cellules tubulaires chez les rats et/ou souris exposés à 500 et 1000 mg/kg pc/j (gavage, 5 j/sem, pendant 103 semaines) [36, 37].
- Effets immunotoxiques : Des effets immunotoxiques ont été rapportés chez des souris exposées via l’eau de boisson : diminution de l’hypersensibilité retardée (mâles, 660 mg/kg, pendant 4 à 6 mois) et altération de l’immunité humorale (femelles, 437 et 793 mg/kg) [38]. Par inhalation, une immunosuppression a aussi été rapportée chez le rat (1000 ppm, 6 h/j, 5 j/sem pendant 4 sem) [39].
Effets génotoxiques [1]
Les résultats des différents essais réalisés aussi bien in vitro que in vivo, ne sont pas cohérents. Les résultats positifs proviennent le plus souvent d’études anciennes, avec de fortes doses et en présence de stabilisants.
In vitro
Les tests bactériens effectués sur différentes souches de S. typhimurium donnent des résultats négatifs ou légèrement positifs, avec ou sans activation métabolique. Les tests réalisés avec des vapeurs de trichloroéthylène stabilisé par des époxydes sont majoritairement positifs avec ou sans activation métabolique ; les époxydes étant mutagènes, il est difficile de différencier l’action des deux substances[40]. Les tests réalisés avec des vapeurs de trichloroéthylène non stabilisé donnent des résultats négatifs, avec activation métabolique [40].
Les résultats obtenus dans les études menées sur des cellules de mammifères sont mitigés :
- positifs sur les hépatocytes de rats et humains (cassures simple-brin, micronoyaux, adduits aux protéines) et sur les cellules embryonnaires de rat (transformation cellulaire) ;
- négatifs sur cellules embryonnaires de hamster, avec ou sans activation métabolique (TCE non stabilisé, transformation cellulaire et aberration chromosomique).
In vivo
- Par inhalation, le trichloroéthylène n’est mutagène ni pour les cellules somatiques, ni pour les cellules germinales de rongeurs. Des résultats négatifs ont été obtenus dans les tests suivants :
- aberration chromosomique dans les cellules de moelle osseuse de rats et de souris (0-5-500-5000 ppm pendant 6 heures) ;
- micronoyau dans les cellules de moelle osseuse de souris (0-5-500-5000 ppm pendant 6 heures) ;
- échange de chromatides sœurs dans les cellules de moelle osseuse de rats et de souris (0-5-500-5000 ppm pendant 6 heures) ;
- test des comètes dans les cellules des tubules proximaux de rats (500-1000-2000 ppm, 6 h/j, 5 j) ;
- mutation létale dominante dans les spermatides de souris (50, 202, 450 ppm pendant 24 heures) et micronoyaux (5, 50, 500 ppm pendant 5 jours).
Une augmentation de la fréquence de micronoyaux est uniquement rapportée dans les cellules de moelle osseuse de rats (0-5-500-5000 ppm pendant 6 heures).
- Par voie orale et intra-péritonéale, des résultats positifs ont été obtenus chez le rat et la souris, le plus souvent pour de fortes doses :
- perturbation mitotique et micronoyau dans les cellules de moelle osseuse de rats (500 à 4000 mg/kg, pendant 6 à 48 heures) ;
- augmentation de la fréquence des micronoyaux dans les cellules rénales de rats (une dose correspondant à 1/7 de la DL50, soit entre 770 et 1028 mg/kg) ;
- augmentation de la fréquence des cassures simple brin et des micronoyaux dans les cellules rénales de rats (une dose correspondant à la moitié de la DL50, soit entre 2700 et 3600 mg/kg) ;
- augmentation de la fréquence des cassures simple brin dans les cellules hépatiques de rats et de souris (dose unique, respectivement de 3900 mg/kg et 1500 mg/kg) ;
- augmentation de la fréquence des cassures simple brin dans les cellules hépatiques et rénales de souris (i.p., 1310 mg/kg), mais avec une réparation complète après 24 heures ;
- augmentation des dommages à l’ADN hépatiques chez le rat (i.p., 100-500-1000 mg/kg) ;
- augmentation de la quantité d’adduits à l’ADN et/ou aux protéines au niveau du foie de rats et de souris (i.p., jusqu’à 1000 mg/kg).
L’absence d’aberration chromosomique est toutefois observée dans les cellules de moelle osseuse de souris (500 à 4000 mg/kg, pendant 6 à 48 heures).
L’implication d’un ou plusieurs des métabolites du TCE est probable dans les dommages chromosomiques observés, les tests réalisés directement sur les métabolites donnant des résultats positifs pour des doses plus faibles [1].
Effets cancérogènes
Le trichloroéthylène est cancérogène pour le rat et la souris par voie orale et par inhalation ; les tumeurs sont induites au niveau de sites différents selon l'espèce et la voie d'exposition.
Par voie orale, le trichloroéthylène, avec ou sans stabilisant (composés de types époxydes, eux-mêmes cancérogènes), augmente le taux de tumeurs hépatiques bénignes et malignes chez la souris (à partir de 1000 mg/kg/j). Chez le rat mâle, il augmente le taux de tumeurs rénales (adénomes à partir de 500 mg/kg/j). Une augmentation dose-dépendante du nombre de tumeurs interstitielles du testicule est aussi rapportée (500 et 1000 mg/kg pc/j, gavage, 5 j/sem, 104 sem)[36].
Par inhalation, chez la souris, le trichloroéthylène augmente le taux de lymphomes, d’adénomes et de carcinomes hépatiques (à partir de 600 ppm, 7 h/j, 5 j/sem, 78 semaines) et d’adénomes pulmonaires (300 et 600 ppm, 7 h/j, 5 j/sem, 78 semaines, sans époxyde). Chez les souris et rats femelles exposées pendant 2 ans à du trichloroéthylène stabilisé par des époxydes (0-50-150-450 ppm, 7 h/j, 5 j/sem), aucune augmentation du nombre de tumeurs n’a été observée chez le rat ; chez la souris, une hausse de l’incidence des adénocarcinomes pulmonaires est rapportée à 150 et 450 ppm [41].
Chez le rat mâle, une augmentation dose-dépendante du nombre de tumeurs des cellules interstitielles testiculaires est observée (cellules de Leydig, 0-100-300-600 ppm de TCE sans époxyde, 7 h/j, 5 j/sem, 104 semaines) ; une légère augmentation des adénocarcinomes des tubules rénaux est observée à 600 ppm [1]. Le trichloroéthylène n’est pas cancérogène chez le hamster.
Le trichloroéthylène ou son métabolite l’oxyde de trichloroéthylène n’augmentent pas le taux de tumeurs cutanées ou de sarcomes locaux chez la souris après application cutanée ou injection sous cutanée.
Mode d'action [1, 8]
Il semble que le développement, chez la souris, de tumeurs hépatiques, après exposition au trichloroéthylène, soit lié à la manière dont celui-ci est métabolisé. Dans cette espèce, la voie préférentielle est l’oxydation, dans le foie, en acide trichloroacétique, inducteur de la prolifération des peroxysomes et de la multiplication cellulaire. Ces effets combinés mènent au développement de tumeurs. In vitro, les hépatocytes de souris métabolisent le trichloroéthylène en acide trichloroacétique en quantités respectivement 40 et 120 fois plus importantes que ceux du rat et de l’homme.
Le rat ne développe pas de tumeur hépatique, bien qu’in vitro, ses hépatocytes présentent une prolifération des peroxysomes en réponse à l’acide trichloroacétique, ce qui n’est pas le cas des hépatocytes humains. Le rôle de l’acide dichloroacétique a été moins étudié, mais il semble spécifique à la souris.
La croissance de tumeurs pulmonaires, chez la souris, est de la même façon liée au métabolisme. Les cellules de Clara, qui, in vitro, métabolisent le trichloroéthylène majoritairement en hydrate de chloral, sont incapables de conversion ultérieure. L’hydrate de chloral (mutagène et clastogène) s’accumule dans ces cellules et provoque des cycles répétés de destruction et multiplication cellulaires qui pourraient mener à la formation de tumeurs.
Le métabolisme pulmonaire, chez le rat et le cobaye, ne s’arrête pas à l’hydrate de chloral, mais continue jusqu’au trichloroéthanol. Chez l’Homme, les cellules pulmonaires, in vitro, métabolisent, de façon minime, le trichloroéthylène en hydrate de chloral.
Par voie orale, le métabolisme du trichloroéthylène ayant lieu avant qu’il n’atteigne le poumon, les cellules de Clara ne sont pas soumises à l’effet de l’hydrate de chloral.
Les tumeurs rénales chez le rat ne sont pas liées à une accumulation de gouttelettes hyalines ou d’α2-µ-globuline ; elles seraient plutôt le résultat d’une cytotoxicité et d’une régénération persistantes.
Un des modes d’action proposés impliquerait la formation de dichlorovinylcystéine, via la voie de conjugaison avec le glutathion, qui serait ensuite activée par la β-lyase des tubes rénaux en métabolites réactifs connus comme néphrotoxiques et mutagènes.
Un second mode d’action proposé impliquerait une augmentation, induite par le trichloroéthylène, de l’excrétion d’acide formique suite à un effet sur le métabolisme de la méthionine.
Effets sur la reproduction [1]
Le trichloroéthylène agit sur le système reproducteur masculin. Aucun effet sur le développement n’est rapporté par inhalation à des concentrations non toxiques pour les mères ; par voie orale, des effets sur le développement neurologique, sur le système immunitaire et des malformations cardiaques sont observés, sans toxicité maternelle.
Fertilité
Une exposition courte au trichloroéthylène par inhalation (jusqu’à 2000 ppm, 4 h/j, 5 j) augmente le pourcentage d’anomalies du sperme chez la souris, 28 jours après l’exposition ; le NOAEL est de 200 ppm [2]. Chez la souris femelle (gavage, 10 - 100 - 1000 mg/kg/j, 2 semaines avant l’accouplement, pendant l’accouplement et la gestation), le trichloroéthylène n’agit ni sur la fertilité, ni sur le cycle œstral, ni sur la taille des portées[42].
Chez des rats exposés à 376 ppm de TCE, 4 h/j, 5 j/sem pendant 12 ou 24 semaines, une diminution des taux de testostérone et de 17β-hydroxy stéroïde déshydrogénase, une atrophie testiculaire et une diminution du nombre de spermatozoïdes et de leur motilité ont été mesurées [1]. Une dégénérescence de l’épithélium épididymaire est rapportée chez des rats exposés de 376 à 1000 ppm, pendant une ou 2 semaines [43].
Bien que la morphologie spermatique et le taux de testostérone ne soient pas affectés par l’exposition au trichloroéthylène, une forte dose (jusqu’à 500 ppm, 7 h/j, 5 jours par inhalation ou 1000 mg/kg/j, 5 j/sem, 6 semaines par voie orale) agit sur le comportement du rat mâle (augmentation de la latence d’éjaculation, contact génital incomplet) et diminue la survie des petits.
Développement
Par inhalation, à des concentrations non toxiques pour les mères (jusqu’à 1800 ppm, 6 h/j, GD0 à GD20), le trichloroéthylène n’agit pas sur le développement du rat, de la souris ou du lapin.
En revanche, par voie orale, l’exposition pendant la gestation et/ou postnatale, à de faibles doses (< 10 mg/kg/j) semble induire, chez le rat, une neurotoxicité du développement caractérisée, chez les petits, par de légères modifications de comportement (augmentation de l’activité exploratrice), de métabolisme cérébral (baisse de l’incorporation de glucose dans les tissus) et de morphologie cérébrale (diminution du nombre de fibres de myéline dans l’hippocampe) [44]. Une diminution de la taille des portées est observée chez des rates gestantes exposées par gavage à 1125 mg/kg/j de TCE du 6ème au 19ème jour de gestation, en présence de toxicité maternelle marquée (diminution du poids corporel, ataxie, baisse de l’activité motrice) [1]. Dans cette même étude, une augmentation de l’incidence des micro- et anophthalmies liée à la dose est rapportée (0-475-633-844-1125 mg/kg/j). Les études chez la souris, réalisées à des doses non toxiques pour les mères, ne mettent en évidence aucun effet sur le développement.
L’incidence de malformations cardiaques est augmentée chez les fœtus de rats suite à une exposition des mères avant et/ou pendant la gestation (0,218 et 129 mg/kg/j, via l’eau de boisson), en l’absence de toxicité maternelle [45, 46].
Chez la souris, l’immuno-régulation des nouveau-nés est altérée suite à une exposition des mères durant la gestation et la lactation (doses maternelles de 123 et 684 mg/kg/j) et à une exposition des nouveau-nés via l’eau de boisson pendant 4 semaines ensuite (doses nouveau-nés de 122 et 553 mg/kg/j) [47]. D’autres effets sur le système immunitaire, comme l’augmentation du poids de la rate ou l'augmentation du temps de la réponse de type hypersensibilité retardée, sont rapportés chez des souriceaux âgés de 8 semaines, après exposition des mères pendant l’accouplement, la gestation et l’allaitement (souris, 0-0,37 et 3,7 mg/kg/j) [1].
Neurotoxicité [2]
Des effets sur le système nerveux sont mis en évidence chez le rongeur, par voie orale et respiratoire.
Les effets sur le système nerveux, mis en évidence dans différentes études chez le rat, sont les suivants :
- modification des potentiels évoqués dans le cortex visuel à partir de 800 ppm (mâles et femelles, exposés à 250-800 et 2500 ppm, 6h/j, 5j/sem, 13 sem) ;
- augmentation du temps de latence dans un test de discrimination visuelle, sans aucune autre atteinte, à 1000 ppm (pendant 18 semaines) ;
- modification des réflexes auditifs à partir de 2400 ppm (pendant 12 semaines).
Des effets neurologiques sont aussi observés par voie orale. Des rats adultes mâles, exposés à 312 mg/l de trichloroéthylène dans l'eau de boisson durant quatre semaines, suivies par deux semaines sans exposition puis deux autres semaines d'exposition, ont présenté des performances accrues pour un test neurocomportemental (Morris swim test) et une diminution de la myélinisation du cerveau. Une exposition de 10 semaines (5 j/sem) à 2500 mg/kg/j de trichloroéthylène dans l'huile par gavage a induit une altération de la myélinisation du nerf trijumeau chez le rat. Une ataxie, une léthargie et des convulsions ont été observées pour des expositions chroniques chez le rat (500 ou 1000 ppm par gavage dans l'eau, 103 sem) et la souris (1800 mg/kg/j chez les femelles et 2400 mg/kg/j chez les mâles 54 sem).
Une corrélation a été montrée entre la concentration en trichloroéthylène dans le cerveau et les modifications de comportement et du cycle veille/sommeil. Le NOAEL pour la toxicité comportementale est de 250 ppm chez le rat.
-
Toxicité sur l’Homme
Le trichloroéthylène est irritant pour les voies respiratoires supérieures, les yeux et la peau. L'inhalation de fortes concentrations de trichloroéthylène provoque une dépression du système nerveux central pouvant aller jusqu'au décès, une irritation bronchique et des troubles du rythme cardiaque. Lors d'ingestion apparaissent des troubles digestifs, neurologiques, cardiaques et respiratoires souvent graves. L'exposition répétée par inhalation peut provoquer des atteintes neuropsychiques parfois sévères. Une dermatite d’irritation est observée en cas de contacts répétés. Le trichloroéthylène semble perturber le système immunitaire et avoir un rôle dans la maladie veino-occlusive pulmonaire. Les données épidémiologiques mettent en évidence un effet cancérogène du trichloroéthylène pour le rein ; des associations causales moins fortes ont été établies pour le cancer hépatique et le lymphome non-Hodgkinien. Les données humaines ne permettent pas de conclure vis-à-vis des risques pour la reproduction.
Toxicité aiguë [1, 7, 10, 13, 48]
L’utilisation ancienne du trichloroéthylène comme anesthésique, des rapports de cas d’intoxication, des expositions contrôlées chez des volontaires ainsi que son utilisation comme produit de toxicomanie en « sniffage » ont fourni de nombreuses données.
Le trichloroéthylène est irritant pour les voies respiratoires supérieures, les yeux et la peau. Les projections oculaires entraînent des érosions superficielles de la cornée et de la conjonctive.
Par inhalation, l’intoxication aiguë se traduit principalement par des effets neurotoxiques, respiratoires et cardiotoxiques. Elle est à l’origine d’une dépression de la conscience : de la simple ébriété au coma profond et au décès. Elle s’accompagne de troubles respiratoires et d’une atteinte pulmonaire se traduisant par une polypnée et des signes d’irritation du tractus bronchique. Des arythmies cardiaques sont rapportées dans plusieurs études, surtout dans les années 50/60 et encore de nos jours lors d’expositions massives. Des rares atteintes hépatiques (cytolyses hépatiques le plus souvent infra-cliniques et transitoires ainsi que des cas graves, isolés, d’hépatite fulminante suite à l’inhalation de fortes concentrations) ont été décrites. Un cas de néphrite interstitielle aiguë avec nécrose secondaire tubulaire a aussi été décrit après une exposition importante au trichloroéthylène pendant 8 heures [49]. Des atteintes des nerfs crâniens (notamment nerfs trijumeaux et optique) ont été publiées lors d’expositions professionnelles entraînant des effets narcotiques ou suite à des anesthésies utilisant des circuits fermés contenant de la soude. Ces atteintes semblent être causées par le dichloroacétylène (produit de décomposition du trichloroéthylène formé sous l’action de la chaleur et de la lumière ou en présence d’alcalins puissants).
Des centaines de cas d’éruptions généralisées à type de toxidermies ont été décrits jusqu’aux années 1990 dans les pays industrialisés et postérieurement dans les pays asiatiques récemment industrialisés, où ces manifestations sont devenues préoccupantes et des facteurs de susceptibilité génétique ont été identifiés. Il s’agit principalement de la nécrolyse épidermique toxique (syndromes de Stevens-Johnson et de Lyell) et du syndrome d’hypersensibilité type DRESS (drug rash with eosinophilia and systemic symptoms), survenant entre 2 à 6 semaines après l’exposition. Les effets systémiques incluent fièvre, hyperéosinophilie et une cytolyse hépatique. Ces manifestations sont rares mais potentiellement mortelles [50]. Les additifs des préparations commerciales pourraient aussi jouer un rôle dans la survenue de ces manifestations.
L’intoxication aiguë par ingestion est marquée par l’apparition, après un intervalle libre, des signes cliniques suivants :
- digestifs : vomissements et diarrhées, érosions caustiques, perforation et nécrose; des décès suite à une défaillance hépatorénale ont été décrits;
- neurologiques : céphalées, ébriété, obnubilation pouvant évoluer vers un coma calme aréflexique parfois entrecoupé d’épisodes hypertoniques ;
- cardiaques : troubles de l’excitabilité myocardique (extrasystoles ventriculaires isolées ou en salves, fibrillation ou tachycardie ventriculaire), troubles amplifiés par les situations d’hyperadrénergie. Des arrêts cardiaques ont été décrits ;
- respiratoires : pneumopathie de déglutition (fausse route) avec possibilité de surinfections broncho pulmonaires parfois gravissimes.
Toxicité chronique [1, 7, 10, 13, 48]
Le système nerveux central est le principal organe cible. L’exposition chronique à des niveaux non quantifiés de trichloroéthylène a été associée à des atteintes neuropsychiques, caractérisées par les effets suivants : asthénie, céphalées, inappétence, troubles de la mémoire, de l’humeur, du sommeil… Il peut s’accompagner d’un syndrome neurovégétatif avec sueurs profuses, et de troubles fonctionnels divers, vertiges, sensations ébrieuses, troubles des fonctions auditives, visuelles et digestive (nausées, ballonnement abdominal...). Des neuropathies sensitivomotrices ont été rapportées, ainsi que des atteintes de certains nerfs crâniens (le trijumeau et le facial semblent particulièrement sensibles, mais les nerfs olfactif et vestibulocochléaire ont aussi été affectés lors de l’exposition aux produits de dégradation du trichloroéthylène, comme lors des intoxications aiguës).
Des études suggèrent un lien entre l’exposition professionnelle au trichloroéthylène et la survenue de la maladie de Parkinson [51, 52].
Comme de nombreux solvants, le trichloroéthylène dégraisse la peau et il est susceptible de provoquer des dermatites de contact d’irritation.
Il n’y a pas d’évidence d’un excès de risque de maladies cardiovasculaires, dont des troubles du rythme, chez les travailleurs exposés de façon chronique au trichloroéthylène.
Plusieurs études rapportent des altérations de la fonction hépatique et des hépatomégalies, alors que d’autres sont négatives, mais l’information sur les niveaux d’exposition et les co-expositions sont absentes ou non prises en compte. Un effet antabuse peut apparaître en cas de consommation simultanée d’alcool.
L’augmentation des taux urinaires de certains marqueurs de la fonction rénale (notamment albumine, alpha-1-microglobuline, NAG - N-acétyl-beta-D-glucosaminidase) documentée dans plusieurs études transversales suggère la possibilité d’une atteinte glomérulaire et tubulaire. Néanmoins, d’autres études (dont de cohorte) n’ont retrouvé aucune association entre une exposition au trichloroéthylène et des atteintes rénales non cancéreuses.
Un lien épidémiologique a été décrit entre des pneumatoses kystiques coliques et l’exposition au trichloroéthylène chez des travailleurs japonais [53]. Un cas français a aussi été rapporté [54].
Le trichloroéthylène a des effets sur le système immunitaire et vasculaire : il a été associé à la sclérose systémique et à la maladie veino-occlusive pulmonaire (une forme rare d’hypertension pulmonaire caractérisée par une atteinte veinulaire prédominante associée à une prolifération capillaire) [55].
Des études réalisées dans 6 usines en Chine ont mis en évidence une diminution significative de certains marqueurs de la fonction immunitaire (taux de lymphocytes circulants, immunoglobulines sériques, cytokines inflammatoires) chez les salariés utilisant le tricholoéthylène comme agent de nettoyage, par rapport aux travailleurs non exposés [56 à 59].
Effets génotoxiques [1]
Plusieurs études ont été consacrées à l’activité possiblement génotoxique du trichloroéthylène chez l’homme.
Trois études ont recherché une augmentation du taux d’échanges des chromatides-soeurs sur des lymphocytes de travailleurs exposés au trichloroéthylène ([60 à 62] cités dans [1]). Il n’a pas été montré de différence entre les groupes exposés/non exposés après prise en compte du tabagisme, mais la petite taille des groupes et les co-expositions à d’autres solvants ne permettent pas de conclure.
Lors d’une étude sur des aberrations chromosomiques sur les lymphocytes de personnels exposés au trichloroéthylène, il a été montré une augmentation du nombre de métaphases présentant des anomalies incluant les lacunes ; le test sur la fréquence de non-disjonction pour le chromosome Y dans le sperme était négatif [63]. Ces résultats ont peu de signification en terme de risque d’autant que le tabagisme ainsi que d’autres facteurs potentiels de mutagénicité n’ont pas été pris en compte.
Effets cancérogènes [1, 8, 64]
En milieu professionnel, de nombreuses études épidémiologiques ont été consacrées au potentiel cancérogène du trichloroéthylène[1]. En 2012, le CIRC a classé le trichloréthylène comme cancérogène pour l’Homme (groupe 1), avec des indications suffisantes pour le cancer du rein et des indications limitées pour le cancer du foie et le lymphome non-Hodgkinien [8, 64]. Une susceptibilité génétique a été identifiée dans la cancérogénèse rénale, impliquant la voie métabolique faisant intervenir la conjugaison au glutathion : dans une étude cas-témoins, le risque était augmenté chez les travailleurs exposés porteurs d’une enzyme glutathion S transférase (GSTT1) active, mais il ne l’était pas chez les travailleurs exposés sans activité GSTT1 [65].
Pour les autres localisations de cancer, les données des études épidémiologiques sont insuffisantes ou inadaptées pour évaluer les associations. Les biais consistent principalement en un temps de suivi trop court, des co-expositions et des facteurs de confusion non pris en compte, des données sur l’exposition peu fiables et souvent qualitatives ou semi-quantitatives.
Effets sur la reproduction [17, 66]
Quelques études sur les paramètres spermatiques menées chez des travailleurs exposés au trichloroéthylène sont majoritairement négatives. Une augmentation du taux de spermatozoïdes anormaux a été observée dans une étude comportant des limites méthodologiques (ex. absence de groupe contrôle) [67].
Une réduction de la fécondabilité et des altérations du cycle menstruel ont été rapportées chez des travailleuses exposées au trichloroéthylène, dans des études anciennes et souvent avec des co-expositions à d’autres solvants.
Ces données sont insuffisantes pour évaluer l’impact du trichloroéthylène sur la fertilité masculine et féminine.
Des études épidémiologiques ont été réalisées en milieu professionnel afin de mettre en évidence un lien entre l’exposition aux solvants et les issues de grossesse. Si certaines issues de grossesse ont été associées à l’exposition professionnelle de la mère aux solvants (fentes orales, retards de croissance, malformations), il n’est pas possible de conclure quant au rôle précis du trichloroéthylène. Cependant, 3 études finlandaises en population professionnelle (Taskinen et al.,1989 ; Lindbohm et al., 1990 ; Tola et al., 1980 cités dans [7] et NRC, 2006) n’ont pas mis en évidence un risque accru de fausse couche et malformation congénitale suite à une exposition au TCE [17].
-
Interférences métaboliques
-
Cohérence des réponses biologiques chez l'homme et l'animal
