Cette méthode décrit le prélèvement Actif sur cassette ouverte et l'analyse par microscopie électronique à transmission de la (des) substance(s) : Amiante
Données de validation : Informations complémentaires
Substances
Informations générales
Propriétés physico-chimiques
| Nom | N° CAS | Formule chimique | Classification CMR |
|---|---|---|---|
| Amiante | 1332-21-4 |
C1A |
Plus d'informations
| Nom | Masse molaire | Densité | Synonymes | Fiche toxicologique |
|---|---|---|---|---|
| Amiante |
Familles de substances
- FIBRES
Principe et informations
Cette méthode est utilisée pour des mesures individuelles.
Elle permet de déterminer la nature, les dimensions et les concentrations des fibres d'amiante présentes mais ne permet pas de différencier les fibres issues d'amphiboles asbestiformes de celles issues d'autres variétés du même minéral amphibole.
L’amiante se trouve souvent, non pas sous forme de fibres individuelles, mais sous forme de structures agrégées très complexes qui peuvent aussi être ou non associées à des particules d’autre nature.
Il existe différents types de structures fibreuses : fibre individuelle, faisceau de fibres, agglomérat ou matrice-composite ou groupement contigu de fibres avec ou sans particules associées. Des schémas illustrant ces différentes structures sont présentés dans les données de validation-informations complémentaires.
Communément le terme fibre est employé plus largement pour décrire toute structure fibreuse comptée qui sera classée comme fibre pour rendre les résultats d’analyses qualitatifs ou quantitatifs.
Les différents types d'amiante sont des fibres minérales naturelles appartenant à 2 groupes minéralogiques : les serpentines (nature chimique : silicate de magnésium hydraté) et les amphiboles (nature chimique : silicates hydratés de fer, magnésium, sodium et/ou calcium). Le chrysotile (ou amiante blanc ; n° CAS : 132207-32-0) constitue le groupe des serpentines. Le groupe des amphiboles comprend cinq variétés : la crocidolite (ou amiante bleu, appelé également riebeckite ; n° CAS 12001-28-4) ; l'amosite (ou amiante brun, appelé également grunérite ; n° CAS 12172-73-5) ; la trémolite - amiante (n° CAS 77536-68-6) ; l'actinolite - amiante (n° CAS 77536-66-4) et l'anthophyllite - amiante (n° CAS 77526-67-5).
La méthode est basée sur le comptage, par microscopie électronique à transmission, et sur l'identification des fibres d'amiante, par microanalyse X et microdiffraction électronique.
Les fibres à prendre en compte sont celles de longueur supérieure à 5 µm, de largeur inférieure à 3 µm et de rapport longueur/largeur supérieur à 3.
Les particules sont prélevées sur une membrane en mélange d'esters de cellulose. Le filtre (ou une partie) étant calciné, les particules sont alors récupérées dans l'eau puis filtrées sur un filtre en polycarbonate préalablement recouvert d'une couche de carbone. Après filtration, les particules récupérées sont recouvertes d'une seconde couche de carbone. Le filtre en polycarbonate est dissout à l'aide d'un solvant et les fibres et particules sont recueillies sur des grilles, pour observation au microscope électronique à transmission.
Principe de prélèvement et d'analyse
-
État physique
Particules en suspension (liquides ou/et solides) -
Type de prélèvements
Actif -
Nom du dispositif
cassette ouverte -
Plus d'informations
-
Technique analytique
MICROSCOPIE ELECTRONIQUE A TRANSMISSION -
Détecteur
MICROANALYSE X
Domaine d'application
| Substance | Quantité minimum sur le dispositif | Quantité maximum sur le dispositif | Concentration minimum | Concentration maximum | Volume maximum |
|---|---|---|---|---|---|
| Amiante | 7000 structures fibreuses/mm2 |
Réactifs
- ACIDE CHLORHYDRIQUE
- CHLOROFORME
- EAU
Méthode de prélèvement
Un dispositif de prélèvement :
Dispositif N°1
-
Type dispositif
CASSETTE 37 mm 4 pièces MATERIAU CONDUCTEUR -
Support ou substrat de collecte
- MEMBRANE EN MELANGE D'ESTERS DE CELLULOSE 0,45 µm
- TAMPON EN CELLULOSE
-
Commentaires, conseils et consignes
Utiliser des cassettes à usage unique.
La cassette est utilisée ouverte (couvercle ou 1er étage retiré) . Le tampon est déposé sur un niveau intermédiaire et le filtre dessus.
Pour les prélèvements individuels, la cassette doit être dirigée vers le bas.
Conditions de prélèvement
-
Débit de prélèvement (L/min)
3 -
Particularités, commentaires, conseils
Les prélèvements devront être réalisés en suivant les dispositions énoncées dans les décrets et arrêtés relatifs à l'amiante.
Pompe de prélèvement
- Pompe à débit de 3 à 10 L/min
Compléments
Blanc de lot:
Les lots de filtres utilisés doivent subir une vérification préalable de chaque lot fabricant sur au moins 1 filtre pour 1000 conduisant à l'absence de fibres d'amiante sur au moins 0,15% du filtre d'origine. Dans le cas contraire, rechercher la source de contamination.
Blanc de laboratoire :
Un blanc de laboratoire est réalisé par série de calcination. En cas d'analyse, aucune fibre d'amiante ne devra être détectée sur au moins 0,15% de la surface du filtre d'origine. Dans le cas contraire, rechercher la source de contamination.
Blanc de terrain :
Au moins un blanc de terrain par série, par site et par jour doit être effectué. Afin de s’assurer que la préparation et la manipulation des filtres n'entraînent pas de pollution significative, préparer au moins un filtre non prélevé servant de blanc de terrain dans les mêmes conditions. Ce filtre est analysé si nécessaire et aucune fibre d’amiante ne doit être détectée sur au moins 0,15% de la surface du filtre d'origine.
Remarque
Si une recherche de fibres plus courtes est effectuée, seules les fibres de longueur comprise entre 0,5 et 5 µm sont prises en compte dans les résultats.
Préparation des dispositifs de prélèvement en vue d’une intervention en entreprise
Méthode d'analyse
Principe général de l'analyse en laboratoire
Préparation d'analyse
-
Nombre d'étapes de préparation
2 -
Commentaires sur les étapes
Pour éviter toute contamination des échantillons, décontaminer tous les objets en verre avant de les utiliser et lorsque c'est possible, utiliser des matériels et fournitures à usage unique.
Il est recommandé de ne pas effectuer la manipulation d'échantillons d'amiante en vrac et la préparation des filtres de prélèvement dans la même zone.
2 étapes de préparation :
Étape de préparation N°1
-
Solvant ou solution
- ACIDE CHLORHYDRIQUE
- EAU
-
Autres conditions de préparation
- Traitement des filtres prélevés :
Anant toute préparation, nettoyer l'extérieur du système porte-filtre avec une lingette humide. Retirer le substrat de collecte du système porte-filtre. Si une partie de l'échantillon doit être conservée ou si le substrat de collecte est trop chargé, découper une fraction du substrat de collecte à l'aide d'un scalpel. Cette fraction ne devra pas être inférieure à 1/8ème de substrat de collecte. Si le dépôt est manifestement hétérogène, ne pas traiter le substrat de collecte ou bien le traiter dans son intégralité.
Placer le filtre ou la fraction de filtre sur une lame en verre (poussière en contact avec le verre).
Placer la lame horizontalement dans un tube à centrifuger ou dans un petit bécher. Le récipient utilisé est fermé par une feuille d'aluminium percée de petits trous afin de permettre les échanges gazeux.
Placer le récipient dans le four à plasma d'oxygène, l'ouverture (recouverte de papier aluminium) faisant face à l'entrée d'oxygène. La calcination est menée jusqu'à ce que le filtre soit totalement calciné (environ 2 heures).
Récupérer les particules par lavage de la lame à l'eau ultra-pure filtrée et à l'aide d'un grattoir pour décoller la totalité des particules.
Agiter manuellement la suspension obtenue et la filtrer sur un filtre en polycarbonate (0,2 µm) préalablement recouvert d'une couche de carbone en rinçant plusieurs fois le récipient contenant la suspension.
Après filtration, une deuxième couche de carbone est évaporée sur le filtre en polycarbonate de telle sorte que les fibres ou particules soient situées entre ces deux couches.
Remarque : Les poussières acido-sensibles peuvent être éliminées par traitement à l'aicide chlorhydrique 1N, dans le tube ou le bécher, directement sur les résidus de calcination, avant la mise en suspension dans l’eau pendant une durée n’excédant pas 5 minutes.
Étape de préparation N°2
-
Solvant ou solution
- CHLOROFORME
- EAU
-
Autres conditions de préparation
- Préparation des grilles de microscope électronique :
Deux méthodes peuvent être utilisées :
1. Préparation des grilles par la méthode du laveur Jaffe
Montage utilisé
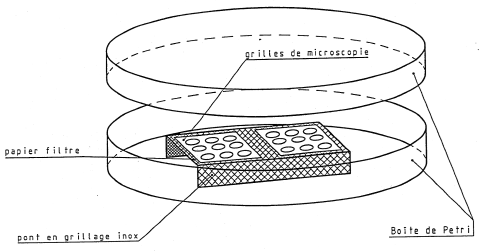
Mode opératoire
Placer plusieurs morceaux de papier-filtre sur le support en acier inoxydable.
Remplir le récipient de chloroforme pour que la surface du bain soit en contact avec la face inférieure du support, de manière à saturer le papier-filtre. Placer au moins deux grilles de microscopie sur un même papier-filtre.
Découper un secteur du filtre en polycarbonate et le placer sur les grilles (réparties sur le centre et la périphérie du secteur exposé) côté carboné sur le dessus.
Mettre le couvercle et laisser dissoudre pendant au moins 8 heures.
2. Préparation des grilles à l'aide de l'appareil de filtration
Montage utilisé
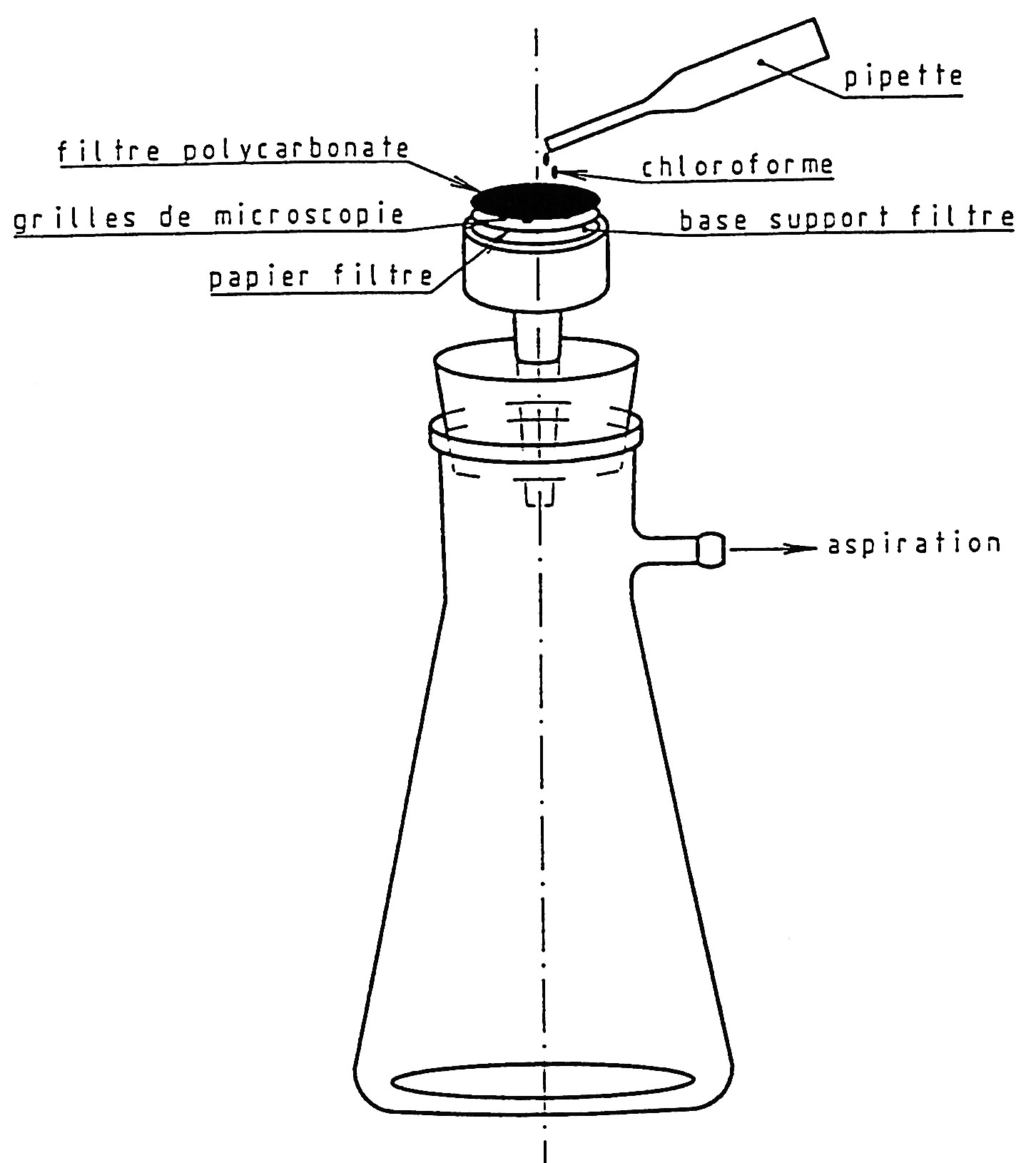
Disposer un papier-filtre sur le fritté d'un appareil de filtration.
Placer quelques grilles sur ce papier et les recouvrir d'une portion du filtre en polycarbonate, surface carbonée vers le haut.
Dissoudre le filtre en filtrant quelques millilitres de chloroforme.
-
Commentaires
- Critère d'acceptation des grilles
Examiner les grilles préparées à faible grossissement (300 à 1 000) pour pouvoir observer toutes les ouvertures de la grille.
La grille sera rejetée si :
- la dissolution du filtre en polycarbonate est incomplète,
- plus du quart des ouvertures de grille est déchiré,
- l'échantillon est surchargé (la grille montre plus de 10 % d'obscurcissement sur la majorité des ouvertures),
- la répartition des particules n'est pas uniforme (ce problème peut être contourné en comptant un nombre plus élevé d'ouvertures de grilles),
- le nombre de structures fibreuses est trop important (plus de 7 000 fibres/mm2).
Les grilles acceptées seront ensuite analysées à plus fort grossissement permettant un comptage plus précis des fibres, par exemple un grossissement de 10 000 est nécessaire pour compter des fibres de longueur supérieure à 5 µm et de largeur inférieure à 3 µm.
Commentaires, conseils, conditions particulières
Les interférences rencontrées sont liées à la présence d'autres minéraux de compositions similaires à celles de l'amiante. L'utilisation d'un diagramme de diffraction électronique à orientation aléatoire diminue le risque d'erreurs d'identification.
Des risques significatifs d'erreurs d'identification se produisent avec l'halloysite, les enroulements de vermiculite ou la palygorskite ; cependant on peut les distinguer du chrysotile par une analyse aux rayons X en dispersion d'énergie et par l'observation de la réflexion de 0,73 nm d'indice de Miller (002) du chrysotile dans le diagramme de diffraction électronique.
Une condition analytique :
Condition analytique N°1
-
Technique analytique
- MICROSCOPIE ELECTRONIQUE A TRANSMISSION
-
Détecteur
- MICROANALYSE X
- MICRODIFFRACTION ELECTRONIQUE
-
Commentaires, conseils ou condition particulières
Le microscope électronique à transmission (MET) doit avoir les caractéristiques suivantes :
- tension d'accélération d'au moins 100 kV,
- résolution spatiale supérieure à 1,0 nm,
- plage de grandissements de 300 à 100 000,
- repères étalonnés pour mesurer les longueurs et largeurs des fibres,
- si besoin, un goniomètre permettant l'orientation de l'échantillon,
- système d'éclairage et condenseur capable de former un faisceau électronique de diamètre inférieur à 250 nm.
Le MET doit également permettre :
- un grossissement direct sur l'écran d'environ 100 000 (pour examen de la morphologie des fibres),
- la réalisation des clichés de diffraction électronique sur des surfaces suffisamment petites.
Il doit être équipé d'un analyseur en dispersion d'énergie des rayons X capable (SDEX) :
- d'atteindre une résolution meilleure que 170 eV (largeur à mi-hauteur) sur le pic K α du Mn,
- de soustraire le bruit de fond,
- d'identifier les pics élémentaires,
- de calculer les surfaces nettes des pics.
Le système SDEX doit permettre de réaliser des analyses quantitatives et d'exploiter les résultats en pourcentage atomique, massique ou en pourcentage d’oxydes. Une fenêtre d’une surface minimale de 30 mm2 est recommandée. En outre, il doit permettre de sauvegarder les acquisitions de spectres des standards d’amiante et les conserver en spectres de références afin d’effectuer des comparaisons avec les spectres d’échantillons de routine.
Étalonnage et expression des résultats
La méthode d'étalonnage indiquée est celle utilisée lors du développement. Elle n'a cependant pas de caractère obligatoire
-
Principe d'étalonnage
externe -
Commentaires
1- Étalonnage et vérification
1.1- Étalonnage et vérification des grandissements
Les grandissements de l'écran du MET sont étalonnés et vérifiés par mesure d'un étalon certifié.
1.2- Étalonnage et vérification de la constante de diffraction
Ces étapes sont réalisées sur des clichés (micrographies ou sur écran) des anneaux de diffraction d'une couche évaporée d'or pour trois longueurs de caméra différentes.
1.3- Microanalyse X
Les critères de performance de l'association MET-SDEX sont déterminés par la mesure du sodium dans la crocidolite. La détection du pic Kα du Na sur des fibres de crocidolite de largeur inférieure à 0,05 µm dans les conditions d'analyse de routine doit répondre aux critères suivants :
- rapport en nombre de coups de Na/Bruit de fond supérieur à 3,
- intensité du pic Kα du Na en nombre de coups supérieur à 5.
L'étalonnage est réalisé à l'aide de matériaux de références (minéraux contenant Na, Mg, Al, Si, K, Ca, et Fe). Ces matériaux sont des silicates avec des matrices se rapprochant le plus possible des amphiboles ou de la serpentine et dont les fragments sont de compositions homogènes.
La calibration du système doit être effectuée régulièrement.
2- Méthode de comptage des structures par microscopie électronique à transmission
Plusieurs paramètres doivent être contrôlés :
- mesure de la surface effective de filtration,
- mesure de la surface moyenne des ouvertures de grille. Le nombre de grilles à vérifier doit être au minimum de 1 % de chaque contenant d’un même lot de fabrication et un minimum de 10 grilles au total. La surface des ouvertures de grilles est mesurée sur 10 ouvertures par grille sur 10 grilles minimum. Les ouvertures choisies sont réparties de manière aléatoire sur la grille. Le coefficient de variation de l'ensemble des surfaces doit être inférieur à 5 %,
- alignement et étalonnage des grandissements du microscope électronique à transmission,
- comptage des structures et mesure des tailles (méthode générale détaillée ci-dessous).
2.1- Méthode générale pour le comptage des structures et la mesure des tailles
(Voir Données de validation)
Utiliser au moins deux grilles préparées à partir d'un même filtre.
Placer une grille dans le microscope et observer une ouverture en ajustant le grandissement sur l'écran à la classe de fibres à dénombrer. Ajuster la hauteur de l'échantillon pour qu'il se trouve au point eucentrique.
Régler l'angle d'inclinaison du goniomètre à zéro.
Explorer la totalité de l'ouverture de grille. Lorsqu'une structure fibreuse est observée, mesurer sur l'écran la longueur et la largeur de l'image de la structure et effectuer les opérations d'identification.
Au moins 4 ouvertures de grille doivent être examinées à partir de 2 grilles minimum.
3- Méthode d'identification des fibres
Étudier dans un premier temps la morphologie des fibres et les classer en deux catégories : les fibres à morphologie tubulaire et les fibres sans morphologie tubulaire.
Pour éviter d'endommager les structures cristallines de certaines fibres, procéder comme suit.
3.1- Analyse en diffraction électronique
Observer un diagramme de diffraction électronique réalisé à partir d'une fibre à orientation aléatoire et comparer ces mesurages à ceux effectués à partir de structures minérales connues.
3.2- Analyse en dispersion d'énergie des rayons X
Effectuer un spectre d'analyse sur la fibre à identifier.
Comparer le spectre obtenu pour l'échantillon aux spectres de différentes variétés d'amiante pour obtenir la composition chimique de la fibre.
Cette technique peut être qualitative ou quantitative.
Remarque
La constitution d'une base de données comportant des spectres de différentes variétés d'amiante et de fibres de diamètres variables permet de réaliser rapidement des identifications en analyse de routine. -
Calcul de la quantité de substance sur le dispositif
La concentration en fibres d'amiante par litre d'air est donnée par :
C = N x SA
avec : SA : sensibilité analytique, en nombre de fibres d'amiante par litre d'air
N : nombre total de fibres d'amiante comptées.
La sensibilité analytique est calculée à partir de la formule :
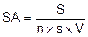
avec : S : surface effective de filtration, en mm2, sur le filtre en polycarbonate
n : nombre d'ouvertures de grilles examinées
s : surface moyenne des ouvertures de grille, en mm2
V : volume d'air prélevé, en L, sur la fraction analysée de la surface du substrat de collecte en mélange d'esters de cellulose (si le substrat de collecte n'a pas été traité dans son intégralité et a été découpé).
Calcul de l'intervalle de confiance
En fonction du nombre total de fibres d'amiante dénombrées et en admettant une statistique de Poisson, l'intervalle de confiance de la concentration est calculé de la façon suivante :
Si le nombre total de fibres d'amiante comptées est inférieur à 4, la limite inférieure de l'intervalle de confiance à 95% correspond à moins d'une fibre dénombrée et n'a donc pas de signification. Le résultat est rendu sous la forme "inférieur à" la limite supérieure de l'intervalle de confiance unilatérale à 95% de la concentration. Par exemple, pour 0, 1, 2 ou 3 fibres dénombrées, les limites supérieures du nombre de fibres à utiliser pour calculer la limite supérieure de la concentration sont respectivement 2,99 – 4,74 – 6,20 et 7,75.
Si le nombre total de fibres d'amiante comptées est supérieur à 4, les limites inférieures et supérieures de l'intervalle de confiance bilatérale à 95% de la concentration sont calculées à partir de l'intervalle de confiance du nombre de fibres dénombrées tel qu'il est donné dans le tableau ci-dessous :
Nombre de fibres comptées
Limite
inférieure
Limite supérieure
Nombre de fibres comptées
Limite inférieure
Limite supérieure
4 1,09 10,24 30 20,24 42,83 5 1,62 11,67 35 24,38 48,68 6 2,2 13,06 40 28,57 54,47 7 2,81 14,42 45 32,82 60,21 8 3,45 15,76 50 37,11 65,92 9 4,11 17,08 60 45,78 77,23 10 4,79 18,39 70 54,57 88,44 15 8,4 24,74 80 63,44 99,57 20 12,22 30,89 90 72,37 110,63 25 16,18 36,9 100 81,36 121,66
Bibliographie
- NF X 43-050. Juillet 2021. Détermination de la concentration en fibre d'amiante par microscopie électronique à transmission. Méthode indirecte. Paris-La-Défense, AFNOR, 2021, 103 p.
- NF X 43-269. Décembre 2017. Qualité de l’air – Air des lieux de travail – Prélèvement sur filtre à membrane pour la détermination de la concentration en nombre de fibres par les techniques de microscopie: MOCP, MEBA et META – Comptage par MOCP. La Plaine Saint-Denis, AFNOR, 2017, 63 p.
- Décret n°2012-639 du 04 mai 2012 relatif aux risques d’exposition à l’amiante.
Historique
| Version | Date | Modification(s) faisant l’objet | Paragraphes |
|---|---|---|---|
| 010 |
| Création et mises à jour |
|
| 010/V01 | 17/10/2007 | Nouvelle présentation |
|
| 010/V02.01 | Mars 2013, jusqu’au 25/03/2013 | Modification suite à la nouvelle réglementation (décret n°2012-639)
Ajout d’une annexe, numérotation des annexes
Révision de la terminologie | Substance mesurable Domaine d’application Prélèvement – Analyse Matériel de prélèvement Traitement des échantillons Bibliographie
Annexe1 Annexe 2 |
| 010/V02.02 | 26/03/2013 | Description du dispositif de prélèvement | Prélèvement Matériel de prélèvement |
| M-50/V01
| Novembre 2015
| Mise en ligne Prélèvement cassette ouverte - Analyse MET | |
| M-50/V02 | Octobre 2021 | Mise à jour suite à la révision des normes NF X 43-269 et NF X 43-050 | Tous |
Date de mise à jour : octobre 2021
Ancien numéro de fiche MétroPol : 010
