Cette méthode décrit le prélèvement Actif sur CIP10-I et l'analyse par HPLC ; détection UV ; fluorimétrique ; de la (des) substance(s) : Mélanges de mycotoxines dans l'air
Données de validation : Validation complète
- Données de validation pour "4-Déoxynivalénol (DON)" (PDF 387,2 Ko)
- Données de validation pour "Aflatoxines" (PDF 374,5 Ko)
- Données de validation pour "Fumonisine B1" (PDF 387,22 Ko)
- Données de validation pour "HT2 toxine" (PDF 403,49 Ko)
- Données de validation pour "Ochratoxine A" (PDF 403,15 Ko)
- Données de validation pour "T2 toxine" (PDF 403,49 Ko)
- Données de validation pour "Zéaralénone" (PDF 382,17 Ko)
Substances
Informations générales
Propriétés physico-chimiques
| Nom | N° CAS | Formule chimique | Classification CMR |
|---|---|---|---|
| 4-Déoxynivalénol (DON) | 51481-10-8 | C15H20O6 | |
| Aflatoxines | |||
| Fumonisine B1 | 116355-83-0 | C34H59NO15 | |
| HT2 toxine | 26934-87-2 | C22H32O8 | |
| Mélange de mycotoxines | |||
| Ochratoxine A | 303-47-9 | C20H18ClNO6 | |
| T2 toxine | 21259-20-1 | C24H34O9 | |
| Zéaralénone | 17924-92-4 | C18H22O5 |
Plus d'informations
| Nom | Masse molaire | Densité | Synonymes | Fiche toxicologique |
|---|---|---|---|---|
| 4-Déoxynivalénol (DON) | DON | |||
| Aflatoxines | ||||
| Fumonisine B1 | 721,83 | |||
| HT2 toxine | 424,48 | |||
| Mélange de mycotoxines | ||||
| Ochratoxine A | 403,83 | OTA | ||
| T2 toxine | 470,52 | |||
| Zéaralénone | 318,4 | ZEA |
Familles de substances
- AGENTS BIOLOGIQUES
- BIOAEROSOLS
- MYCOTOXINES
Principe et informations
La détermination des concentrations en aflatoxines, ochratoxine A, fumonisine B1, DON, zéaralénone, T2 et/ou HT2 dans les atmosphères de travail est réalisée par :
- prélèvement de l’aérosol de poussières contaminées à l’aide d’un échantillonneur CIP 10 muni d’un sélecteur de la fraction inhalable haute efficacité, équipé d’une coupelle rotative contenant une mousse filtrante en polyuréthane préalablement lavée dans de l'eau savonneuse tiède, rincée à l'eau ultra-pure et séchée, puis lavée à l’acétonitrile et séchée ;
- pesée des coupelles avant et après prélèvement pour déterminer la masse des poussières collectées;
Nota : le prélèvement est validé pour des quantités de poussières dans les coupelles comprises entre 1 mg (en deçà, dosages < limites de quantification des mycotoxines) et 60 mg (au-delà, perte d’efficacité de collecte du CIP10).
- extraction des mycotoxines du média de collecte à l’aide d’un mélange de solvants ;
- purification et concentration de la solution d’extraction sur deux colonnes d’immunoaffinité montées en tandem (AOF puis DZT), qui contiennent respectivement les anticorps de 4 aflatoxines, de l'ochratoxine A et de la fumonisine B1 d’une part, du DON, de la zéaralénone et des 2 mycotoxines T2 et HT2 d’autre part ;
- récupération par 2 mL de méthanol, concentration et partage en 4 aliquotes identiques ;
- analyse des 10 mycotoxines en 5 injections HPLC, avec :
- détection UV et conditions d’élution adaptées successivement au dosage du DON, puis de HT2/ T2 (1ère aliquote),
- détection fluorimétrique et conditions d’élution adaptées au dosage des aflatoxines et de l’OTA (2° aliquote),
- détection fluorimétrique et conditions d’élution adaptées au dosage de la zéaralénone (3° aliquote),
- détection fluorimétrique et conditions d’élution adaptées au dosage de la fumonisine B1 (4° aliquote).
L'intérêt de cette méthode réside dans l'utilisation de 2 colonnes d'immuno-affinité multi-mycotoxines utilisées en tandem, qui permet l’analyse de l'une ou l'autre des 10 mycotoxines sur un même prélèvement d'air, sans avoir à faire le choix a priori de la mycotoxine à doser. Le protocole de préparation des échantillons tient compte de toutes les contraintes dues à l’utilisation des tandems AOF-DZT.
Avertissement : Pour les aflatoxines, le niveau de performances validé expérimentalement reste en deçà de celui estimé pour la méthode individuelle M-45.
Dans ce cas, la méthode multi-mycotoxines pourra constituer une 1ère étape vers un dosage plus précis réalisé, au besoin, sur un autre prélèvement d’air analysé à l’aide d’une colonne IA spécifique.
Principe de prélèvement et d'analyse
-
État physique
Particules en suspension (liquides ou/et solides) -
Type de prélèvements
Actif -
Nom du dispositif
CIP10-I -
Plus d'informations
-
Technique analytique
CHROMATOGRAPHIE EN PHASE LIQUIDE;CHROMATOGRAPHIE EN PHASE LIQUIDE;CHROMATOGRAPHIE EN PHASE LIQUIDE;CHROMATOGRAPHIE EN PHASE LIQUIDE -
Injecteur
PASSEUR AUTOMATIQUE;PASSEUR AUTOMATIQUE;PASSEUR AUTOMATIQUE;PASSEUR AUTOMATIQUE -
Détecteur
ULTRAVIOLET (UV);FLUORIMETRIE;FLUORIMETRIE;FLUORIMETRIE
Domaine d'application
| Substance | Quantité minimum sur le dispositif | Quantité maximum sur le dispositif | Concentration minimum | Concentration maximum | Volume maximum |
|---|---|---|---|---|---|
| 4-Déoxynivalénol (DON) | 40 ng |
500 ng |
|||
| Aflatoxines | environ 25 pg |
environ 350 pg |
|||
| Fumonisine B1 | 30 ng |
300 ng |
|||
| HT2 toxine | 75 ng |
350 ng |
|||
| Mélange de mycotoxines | 1 mg de poussières (voir Principe et informations) |
60 mg de poussières (voir Principe et informations) |
|||
| Ochratoxine A | 50 pg |
5 ng |
|||
| T2 toxine | 75 ng |
700 ng |
|||
| Zéaralénone | 5 ng |
150 ng |
Réactifs
- 2-MERCAPTOETHANOL
- ACETONITRILE
- ACIDE NITRIQUE
- ACIDE PHOSPHORIQUE
- BROMURE DE POTASSIUM
- EAU
- METHANOL
- O-PHTALDIALDEHYDE
- SOLUTION COMMERCIALE PBS pH 7,4
- TETRABORATE DE DISODIUM
Méthode de prélèvement
Un dispositif de prélèvement :
Dispositif N°1
-
Type dispositif
CIP10-Inhalable -
Support ou substrat de collecte
- FILTRE EN MOUSSE POLYURETHANE
-
Commentaires, conseils et consignes

Photo d'un ensemble CIP10-I et représentation schématique du sélecteur de la fraction inhalable avec la coupelle rotative en place.
Conditions de prélèvement
-
Débit de prélèvement (L/min)
10 -
Temps de prélèvement maximum en heures
8
Préparation des dispositifs de prélèvement en vue d’une intervention en entreprise
Méthode d'analyse
Principe général de l'analyse en laboratoire
Préparation d'analyse
-
Durée de conservation prélèvements avant analyse
30 jour(s) -
Conditions de conservation avant analyse
A température ambiante.
-
Nombre d'étapes de préparation
5 -
Commentaires sur les étapes
Réaliser préalablement les pesées des coupelles après prélèvement. Ensuite :
- La première étape consiste à extraire les poussières collectées dans les coupelles, avec un mélange 70/30 méthanol/eau.
- La deuxième étape consiste à diluer avec une solution de tampon PBS.
- La troisième étape consiste à fixer et purifier les mycotoxines, sur le tandem de colonnes d'immunoaffinité (AOF/DZT) contenant des anticorps monoclonaux greffés sur gel de Sépharose. Ces colonnes doivent être stockées non congelées entre 4 °C et 8°C, et utilisées à température ambiante.
- La quatrième étape consiste à récupérer les mycotoxines des colonnes AOF/DZT en éluant par 2 mL de méthanol.
- La cinquième étape est une concentration de l’éluat précédent et la récupération de 4 aliquotes identiques.
-
Durée de conservation échantillon préparé avant analyse
8 jour(s) -
Conditions de conservation échantillon préparé avant analyse
Conservation à 4 °C.
5 étapes de préparation :
Étape de préparation N°1
-
Solvant ou solution
- MELANGE DE SOLVANTS
-
Type de préparation
Extraction -
Volume
10 mL -
Ultrasons
- Temps d'ultrasons : 15 min
-
Commentaires
Extraction des poussières collectées dans la coupelle CIP10 (mousse et parois):
- Transférer la mousse dans un flacon de 20 mL avec 10 mL du solvant de désorption (méthanol/eau 70/30).
- Extraire aux ultra-sons pendant 15 minutes.
- Récupérer les poussières déposées sur les parois de la coupelle par ajout de 3 mL du solvant de désorption dans la coupelle, la refermer avec son couvercle et la soumettre 15 minutes aux ultra-sons également.
- Transférer la totalité de la solution d’extraction à l’aide d’une pipette pasteur en matière plastique dans un flacon de 200 mL.
Étape de préparation N°2
-
Solvant ou solution
- PBS
-
Type de préparation
Dilution -
Volume
160 mL -
Filtration
Au besoin
-
Commentaires
Dilution par 160 mL de solution tampon (pour qu’au final la proportion de solvant organique reste < 5% de sur les colonnes IAC - selon les préconisations du fournisseur -) :
- Diluer la solution d'extraction par 160 mL de tampon PBS (en plusieurs fois, parmi lesquelles celles qui servent à rincer le flacon de 20 mL qui contenait la mousse et la coupelle vide et en aspirant systématiquement le tampon au travers de la mousse, à l'aide de la pipette pasteur).
- Agiter à l’aide d’un barreau magnétique.
- Si la solution est très chargée en poussières, prévoir une filtration au travers d’un cône en papier filtre.
Étape de préparation N°3
-
Solvant ou solution
- PBS
-
Type de préparation
Purification -
Commentaires
- Laisser chaque colonne (AOF ou DZT) se stabiliser à température ambiante pendant 20 minutes puis éliminer la solution de stockage par simple gravité dans une cuve de récupération prévue à cet effet.
- Conditionner chaque colonne IA selon les précaunisations du fournisseur.
- Associer les colonnes d’immuno-affinité en tandem, la colonne AOF au-dessus de la colonne DZT, avec un embout adapté à l’entrée de chacune des 2 colonnes. Remplir chaque colonne de PBS.
- Prévoir un corps de seringue de 20 ou 50 mL comme réservoir de distribution, à remplir en plusieurs fois, et transférer tout le volume de solution échantillon sur la colonne.(voir photo 1)
- Amorcer si besoin l’élution, en douceur, à l’aide d’une pipette Pasteur en verre ou à l’aide d’un faible vide, sans dépasser 5 bars.
- Eliminer le mélange de solvant par soutirage sous vide dans la cuve de récupération, sans amener à sec.
- Les mycotoxines sont maintenant liées aux anticorps monoclonaux spécifiques, présents sur l’une ou l’autre des 2 colonnes.
- Rincer les colonnes IA avec 2 fois 10 mL d’eau, préalablement versés dans le flacon de 200 mL ayant contenu la solution échantillon (pour une récupération complète de celle-ci).
- Eliminer le liquide par soutirage à sec, en douceur et en s’assurant qu’il soit complet.
Photo 1
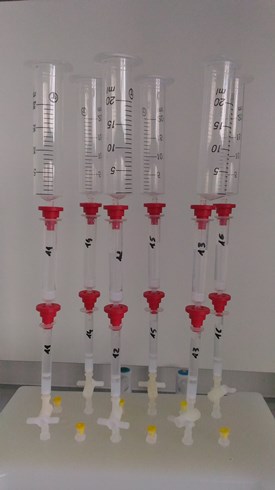
Étape de préparation N°4
-
Solvant ou solution
- METHANOL
-
Type de préparation
Extraction -
Commentaires
Nota : Pour une plus grande précision de l’analyse, les récupérations en flacons, les transferts et les dilutions décrits à partir de cette 4°étape, pourront être réalisés par gravimétrie (sur une balance calibrée) :
Pesée flacon avec bouchon,
Puis, pour les dilutions
Pesée flacon bouché + solvant
Pesée flacon bouché + solvant + solution mycotoxine
Ou, pour les reprises après évaporation à sec
Pesée flacon bouché + solution de reprise,
Etc.
- Tarer au besoin les flacons de 4 mL, prévus pour la récupération de l’extrait, en identifiant chaque flacon et le bouchon associé.
- Remplacer la cuve de récupération par le portoir équipé des flacons de récupération et s’assurer que les aiguilles plongent jusqu’au fond des flacons.
- Déposer 2 mL de méthanol à l’entrée de la colonne AOF, laisser passer au-travers des deux colonnes par gravité, recueillir dans le flacon.
- Récupérer la totalité de l’éluat par soutirage à sec, en douceur et en s’assurant qu’il soit complet, mais sans excès sous peine d’éclaboussures et de perte de produit.
La pesée du volume récupéré permet de vérifier que tout le méthanol a bien été élué des colonnes IA.
Étape de préparation N°5
-
Solvant ou solution
- MELANGE MeOH/EAU 50/50
-
Type de préparation
Concentration -
Évaporation
- Température : 35 °C
- Gaz : Azote
-
Commentaires
L’extrait contenu dans les flacons de récupération est évaporé à sec sous flux d’azote de la façon suivante :
- Déposer les flacons, sans leur bouchon, dans les blocs de l’évaporateur prévu à cet effet (T=35°C, débit d’azote 0,4 PSI).(Voir photo 2)
- Faire descendre les aiguilles au-dessus des flacons sans qu’elles ne trempent dans l’extrait.
- Effectuer cette étape de concentration pendant 1 heure à 1 heure 30.
- Descendre les aiguilles au fur et à mesure de l’évaporation.
Lorsque l’extrait est complètement évaporé :
- Retirer les flacons, remettre leur bouchon et effectuer la pesée du flacon contenant le résidu sec ;
- Reprendre le résidu par 500 μL de méthanol/eau 50/50 et effectuer la pesée du flacon "plein" ;
La solution obtenue est ainsi concentrée 4 fois par-rapport à l’éluat IAC.
- Mélanger à l’aide d’un agitateur Vortex ;
- Partager en 4 aliquotes identiques de 120 µL, transférées dans 4 flacons pour passeur munis d’un insert correctement identifiés (pour chacune des 4 analyses : A+O, Z, Don+HT2+T2 et fumonisine B1).
Photo 2

Commentaires, conseils, conditions particulières
Les 4 parties aliquotes seront analysées en HPLC, dans 5 conditions analytiques différentes adaptées chacune à l'une ou l'autre des 10 mycotoxines.
- Condition analytique 1 : détection UV et éluant adapté au dosage du DON, puis détection UV et éluant adapté au dosage de HT2 et T2 (1ère aliquote),
- Condition analytique 2 : détection fluorimétrique et conditions d’élution adaptées aux aflatoxines et à l’OTA (2° aliquote),
- Condition analytique 3 : détection fluorimétrique et conditions d’élution adaptées à la zéaralénone (3° aliquote),
- Condition analytique 4 : détection fluorimétrique et conditions d’élution adaptées à la fumonisine B1 (4° aliquote).
Les conditions analytiques très précises sont décrites dans les données de validation de chacune des mycotoxines.
Quatre conditions analytiques :
Condition analytique N°1
-
Technique analytique
- CHROMATOGRAPHIE EN PHASE LIQUIDE
-
Injecteur
- PASSEUR AUTOMATIQUE
-
Colonne
- PHASE INVERSE
-
Détecteur
- ULTRAVIOLET (UV)
-
Phase mobile
- EAU
- METHANOL
-
Commentaires, conseils ou condition particulières
Pour le dosage du DON, de HT2 et de T2.
Si le laboratoire ne dispose pas d'un appareil permettant le changement de longueur d'onde et d'éluant en cours d'analyse, procéder en deux injections successives.
Dosage du DON à 220 nm et EAU/MeOH 80/20
Dosage de HT2 et T2 à 202 nm et EAU/MeOH 40/60
Condition analytique N°2
-
Technique analytique
- CHROMATOGRAPHIE EN PHASE LIQUIDE
-
Injecteur
- PASSEUR AUTOMATIQUE
-
Colonne
- PHASE INVERSE
-
Détecteur
- FLUORIMETRIE
-
Phase mobile
- ACETONITRILE
- EAU
-
Commentaires, conseils ou condition particulières
Pour le dosage de l'OTA et des aflatoxines B1, B2, G1 et G2.
Dérivation post-colonne des aflatoxines B1 et G1
Réalisée à l’aide d'un système de dérivation post-colonne (Kobra cell) ou équivalent, qui ne perturbe pas le dosage des aflatoxines B2, G2 et de l’OTA.
Pour assurer un temps d’analyse optimal du dérivé formé, la longueur de la tubulure entre la cellule de dérivation et l’entrée du détecteur doit être déterminée en fonction de son diamètre interne et du débit. Elle sera par exemple, de 34 cm si le diamètre interne est de 0,5 mm avec un débit de 1 mL/min.
Ne jamais laisser la cellule de dérivation au brome sous un flux d’acétonitrile pur.
Stocker la cellule de dérivation au brome sous 100 % d’eau après l’avoir conditionnée à faible débit sous acétonitrile/eau v/v (50/50).
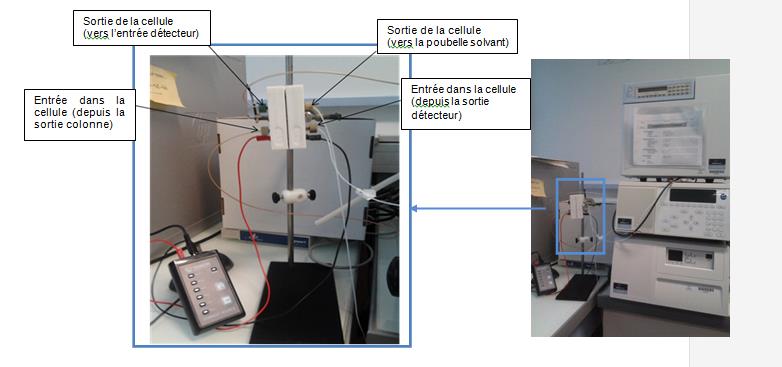
Condition analytique N°3
-
Technique analytique
- CHROMATOGRAPHIE EN PHASE LIQUIDE
-
Injecteur
- PASSEUR AUTOMATIQUE
-
Colonne
- PHASE INVERSE
-
Détecteur
- FLUORIMETRIE
-
Phase mobile
- ACETONITRILE
- EAU
- METHANOL
-
Commentaires, conseils ou condition particulières
Pour le dosage de la zéaralénone.
Condition analytique N°4
-
Technique analytique
- CHROMATOGRAPHIE EN PHASE LIQUIDE
-
Injecteur
- PASSEUR AUTOMATIQUE
-
Colonne
- PHASE INVERSE
-
Détecteur
- FLUORIMETRIE
-
Phase mobile
- EAU
- METHANOL
-
Commentaires, conseils ou condition particulières
Pour le dosage de la fumonisine B1
Analyse à effectuer en dernier. Dans le cas d'une matrice "Maïs" (maïs en grains, déchets de maïs ou produits dérivés de maïs) : lorsque les résultats en zéaralénone montrent une contamination importante, il est préconisé de diluer les échantillons "Fumonisine" (prévus pour une unique injection) avant de les injecter.
Dérivation pré-colonne
Préparation du réactif de dérivation (OPA/MCE) :
Dissoudre 40 mg d’o-phtaldialdéhyde (OPA) dans 1 mL de méthanol, diluer avec 5 mL de tétraborate de disodium (Na2B4O7 ) 0,1M, ajouter 50 μL de 2-mercaptoéthanol (MCE), protéger le réactif OPA/MCE de la lumière, mélanger et homogénéiser par agitation pendant au moins 20 minutes. Le réactif doit être utilisé dans les 24 heures.
Programmation de la dérivation à l’aide du réactif OPA/MCE : 10 μL de réactif sont prélevés dans le flacon dédié et rajoutés au flacon contenant 120 μL d’un échantillon à analyser. L’injection dans la colonne chromatographique doit se faire en moins de 4 minutes.
Étalonnage et expression des résultats
La méthode d'étalonnage utilisée lors du développement de la méthode revêt un caractère obligatoire pour atteindre le niveau de performances validé (sensibilité, rendements, précision)
-
Principe d'étalonnage
externe -
Solvant de l’étalon
- Même solvant que celui des échantillons
-
Commentaires
Les solutions étalons sont préparées par mélange des 7 solutions-mères des produits de référence (aflatoxines, ochratoxine A, fumonisine B1, DON, zéaralénone, T2, HT2), dilutions du mélange, purification sur colonne d’immunoaffinité AOF-DZT et concentration, dans les mêmes conditions que celles adoptées pour les échantillons prélevés dans l’air.
Les informations détaillées sur l'étalonnage sont fournies avec les données de validation.
-
Calcul de la quantité de substance sur le dispositif
1- Déterminer la concentration (Ca) en mycotoxine(s) de chaque aliquote analysée :
Etablir une droite d’étalonnage pour chacune des mycotoxines (Afla G1, Afla G2, Afla B1, Afla B2, OTA, FB1, Zéa, Don, HT2 et T2) en prenant en compte les concentrations exactes (Ee) des étalons injectés.
Les concentrations en l’une ou l’autre des mycotoxines, Ca (pg/mL ou ng/mL), dans les aliquotes-échantillons analysées, sont déterminées à partir de chacune des droites d’étalonnage.
2- Calculer la quantité (Mp) extraite sur tandem AOF-DZT:
Mp (pg ou ng, selon la mycotoxine) = Ca x Vr
avec Vr (mL) : volume de reprise après évaporation à sec;
Ca (pg/mL ou ng/mL) : concentration en mycotoxine de la solution échantillon analysée
La quantité (Mp) est égale à la quantité de mycotoxine prélevée dans la coupelle du CIP10.
Calcul de la concentration (C) dans l'air
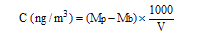
avec : Mp (ng) : masse de mycotoxine dans la coupelle de prélèvement
Mb (ng) : masse moyenne de la mycotoxine dans les blancs de laboratoire
V (L) : volume d'air prélevé.
Il est également possible de calculer la concentration pondérale des poussières contaminées dans l’air
1- Masse des poussières Q (en mg) prélevées dans la coupelle x.
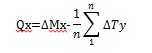
avec, pour n témoins pesés :
Mix : la masse initiale de la xe coupelle utilisée
Mfx : la masse finale de la xe coupelle utilisée
ΔMx : Mfx - Mix, pour la xe coupelle utilisée
Tiy : la masse initiale de la ye coupelle témoin
Tfy : la masse finale de la ye coupelle témoin
ΔT : Tfy - Tiy pour le ye témoin.
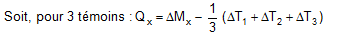
2- Teneur moyenne en chacune des mycotoxines dans les poussières Q (en µg/kg) :
La contamination des poussières dans l’aérosol peut alors être estimée pour chacune des mycotoxines :
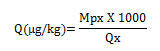
avec Mpx (ng) : masse de la mycotoxine dosée dans la coupelle x
Qx (mg) : quantité de poussières prélevée dans la coupelle x.
Historique
| Version | Date | Modification(s) faisant l'objet de la nouvelle version |
|---|---|---|
| M-426/V-01 | Mars 2018 | Création |
| M-426/V-02 | Juin 2021 | Information supplémentaire relative au domaine d'application |
| M-426/V-03 | Août 2023 | Ajout des débits d'éluant dans les données de validation |
| M-426/V-04 | Avril 2024 | Complément validation 329 aflatoxines, concentration acide nitrique pour éluant |
Date de mise à jour : avril 2024
