Pathologie - Toxicologie
-
Toxicocinétique - Métabolisme
La MOCA est absorbée par inhalation et à travers la peau. Elle est métabolisée par plusieurs voies métaboliques, principalement au niveau du foie. Certains de ses métabolites peuvent se lier de manière covalente aux macromolécules (ADN, protéines). Après une distribution dans tout l’organisme, la majorité de la substance est éliminée en quelques jours via l’urine et les fèces.
Chez l'animal
Absorption
La MOCA peut être absorbée par inhalation et à travers la peau [15]. La pénétration percutanée est rapide. Chez le rat, après application sous pansement occlusif de 2,5 mg de MOCA radiomarquée, l'absorption percutanée est de 22 % le 3e jour [16, 17].
Distribution
À la suite d'une injection intraveineuse de 0,5 mg de MOCA chez le rat, la substance se distribue dans tout l'organisme en 10 minutes. Une heure après, les concentrations les plus importantes sont retrouvées dans l'intestin grêle, le foie, les tissus adipeux, les poumons, les reins, la peau et les glandes surrénales [17, 18]. Après une exposition unique par voie orale chez le rat, la distribution dans les tissus est la suivante : « foie > reins > poumons > rate > vessie > testicules > cerveau > lymphocytes » [19, 20].
Métabolisme
Comme indiqué sur la figure 1, la MOCA est principalement métabolisée au niveau du foie, par plusieurs voies métaboliques faisant intervenir des réactions d'acétylation, d'hydroxylation et oxydations [20, 21] mais également des processus de conjugaison [20].
La MOCA peut être hydroxylée sur les azotes des fonctions amines primaires, sur les cycles et sur le carbone du groupement méthylène ; ces réactions sont catalysées par des monooxygénases à cytochrome P450 et les métabolites hydroxylés peuvent être secondairement sulfo- ou glucuroconjugués. La N-hydroxylation est une réaction d'activation de la MOCA conduisant à la formation de métabolites réactifs. La fonction amine peut également être acétylée et les dérivés obtenus, après d'éventuelles transformations, peuvent être désacétylés [17].
Les différents métabolites de la MOCA ont la capacité de former des liaisons covalentes avec les macromolécules, comme l'ADN et les protéines (dont l'hémoglobine). Après l'administration chez le rat d'une dose unique de 75 mg/kg de MOCA par voie orale, des adduits à l'ADN sont observés principalement au niveau du foie, puis au niveau de la vessie et dans les lymphocytes. L'exposition répétée à 7,5 mg/kg de MOCA, pendant 28 jours, met en évidence une augmentation de liaisons covalentes avec l'hémoglobine, croissante avec le temps [22, 23].
Schéma métabolique
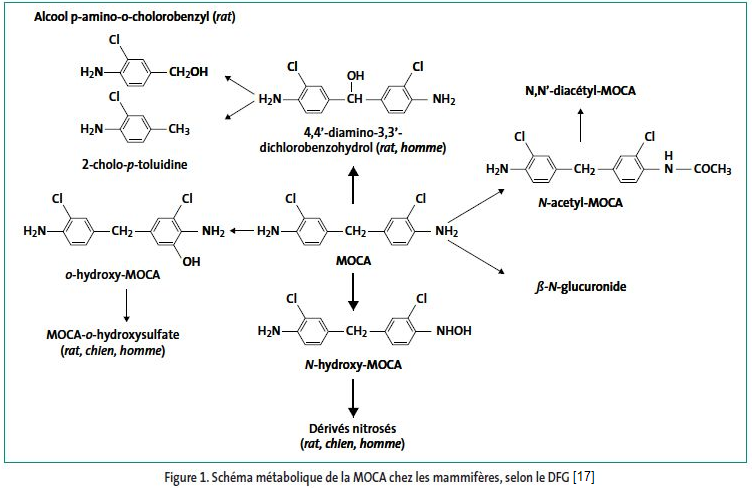
Excrétion
La plupart de la MOCA est éliminée en quelques jours via les urines et les fèces : 86,9 % éliminés en 4 jours [16]. Dans les urines, la grande majorité est excrétée dans les 24 premières heures après l'administration par intubation (14,3 %) ; après 5 jours, 16,6 % ont été excrétés [16]. Il en est de même pour l'élimination par les fèces dans lesquelles 53 % de la dose administrée par intubation est détectée le 1er jour [16]. À la suite d'une administration intrapéritonéale, 60 à 69 % de la dose administrée est éliminée dans les fèces, et entre 23 et 41 % est éliminée par les urines, 48 heures après l'administration [24]. Des niveaux d'excrétion similaires sont rapportés à la suite d'administrations par voie orale [17].
Chez le rat, les métabolites identifiés dans les urines, 36 heures après la fin d'une exposition de 4 jours par gavage à 50 mg/kg/j, sont glucurono- et sulfoconjugués ; dans la bile, le principal métabolite est un mono-N-glucuronoconjugué [25].
Chez le chien, le principal métabolite urinaire est un sulfoconjugué de la O-hydroxy-MOCA [26].
Chez l'Homme
Chez l'homme, la MOCA est absorbée principalement par les voies cutanée et respiratoire, dans un rapport de 5 à 1 environ. La pénétration percutanée est considérée comme la principale voie d'exposition chez les salariés.
Quatre-vingt-dix pour cent de la quantité absorbée est métabolisée par le cytochrome P450 en intermédiaires réactifs ; le N-hydroxy-MOCA est le principal métabolite toxique susceptible de se lier avec l'ADN et/ou les protéines pour former des adduits.
Moins de 1 % de la quantité absorbée est éliminée dans les urines sous forme libre, l'élimination étant surtout sous forme conjuguée (glucuro- et acétylée) ; les niveaux de MOCA sous forme glucuroconjuguée sont 3 fois plus élevés que ceux de la MOCA sous forme libre, tandis que la MOCA sous forme N-acétylée représente 10 % de la MOCA éliminée dans les urines. Après une exposition aiguë à de fortes concentrations, le pic d'excrétion urinaire apparaît 4 heures après la fin de l'exposition et la demi-vie d'élimination est d'environ 23 heures.
Surveillance Biologique de l'exposition
Le dosage de la MOCA totale (libre et conjuguée) dans les urines en fin de poste et fin de semaine de travail, reflet de l’exposition de la semaine, est un indicateur très utile pour la surveillance biologique des sujets exposés en raison de la forte pénétration cutanée du produit.
Etant donné que la MOCA est un cancérogène génotoxique sans seuil d'effet, le RAC (ECHA) estime qu'aucune BLV (Biological limit value) basée sur des effets sur la santé ne peut être recommandée. La population générale n'étant pas exposée à la MOCA, cette dernière n'est pas détectée dans les urines de sujets non exposés professionnellement. Ainsi, une BGV (Biological guidance value) est proposée, correspondant à la limite de détection des méthodes analytiques couramment utilisées [28].
-
Mode d'actions
-
Toxicité expérimentale
Toxicité aiguë
La toxicité aiguë de la MOCA est faible, que cela soit par voie orale ou cutanée. Ataxie et cyanose sont rapportées à la suite d’une exposition par voie orale. In vivo, elle s’avère légèrement irritante au niveau de la peau et des yeux. La MOCA n’est pas un sensibilisant cutané.
À la suite d'une exposition par voie orale, ataxie et cyanose sont observées chez les rats, souris et cobaye exposés [29, 30]. Les DL50 varient entre 640 et 880 mg/kg chez la souris, entre 750 et 2 100 mg/kg chez le rat, et elle est de 400 mg/kg chez le cobaye [21, 29].
À la suite d'une application cutanée, la DL50 est supérieure à 5 000 mg/kg chez le lapin [21]. Chez le rat, aucun effet n'est rapporté à la suite de l'application de 2 000 mg/kg de MOCA, sous pansement occlusif pendant 24 heures [30].
Irritation, sensibilisation
Une légère irritation cutanée est observée chez le cobaye ; chez le lapin, une irritation modérée de la conjonctive est rapportée [21, 31]. De récents tests in vitro (sur modèle de peau humaine pour l'irritation cutanée et le test BCOP pour l'irritation oculaire) n'ont montré aucun signe d'irritation [30].
Un test in vivo de stimulation des ganglions lymphatiques, réalisé chez la souris, ne met en évidence aucune sensibilisation cutanée [30].
Toxicité subchronique, chronique
L’administration répétée de MOCA par voie orale est à l’origine d’effets hépatiques, spléniques et rénaux. Cyanose, faiblesse et augmentation des taux de méthémoglobine sont aussi observés chez les rats exposés. Par voie cutanée, une cyanose modérée est aussi rapportée, ainsi qu’une hématurie.
À la suite d'une exposition subchronique par voie orale (0-200-1 000 mg/kg/j pendant 10 jours), des rats présentent une cyanose modérée et une augmentation des taux de méthémoglobine dès 200 mg/kg/j ; les rats exposés à la plus forte dose sont cyanosés, pâles et faibles, et développent une polyurie [21, 32]. À la suite d'une exposition à la MOCA pendant 42 jours pour les mâles ou 42 à 55 jours pour les femelles (gavage, 0-0,4-2-10-50 mg/kg/j), les effets toxiques sont majoritairement hépatiques, et dans une moindre mesure spléniques (dépôt d'hémosidérine) et rénaux (augmentation du poids et modifications histologiques tubulaires). Les atteintes hépatiques se traduisent par une augmentation du poids de l'organe, des modifications des paramètres biologiques sanguins associés (diminution des protéines totales et de l'albumine, augmentation des taux de cholestérol, triglycérides, LDH ou gamma GT) et des changements histopathologiques (hypertrophie hépatocytaire centrolobulaire, dégénérescence graisseuse et nécrose cellulaire). La dose sans effet (DSE) est de 2 mg/kg/j [30].
L'application percutanée de 2 250 mg/kg/j de MOCA chez le lapin pendant 2 semaines est à l'origine d'une cyanose modérée et d'une hématurie la 1re semaine ; la 2e semaine d'exposition, seule la cyanose persiste chez un des 4 lapins exposés [21, 33].
Des modifications en lien avec l'exposition chronique ont été rapportées dans les études de cancérogénèse. Des rats recevant 50 mg/kg pc de MOCA pendant 2 ans en mélange alimentaire, développent des lésions hépatiques non néoplasiques telles qu'une hépatocytomégalie, des modifications lipidiques, une nécrose ou une fibrose. L'incidence et la sévérité de ces effets ne sont pas mentionnées dans l'étude [34]. Une étude menée chez le chien, exposé pendant 9 ans à 7,3 mg/kg/j de MOCA, met en évidence une augmentation des niveaux sériques moyens en ALAT et une hyperplasie du foie chez les animaux exposés [35].
Effets génotoxiques [17]
La MOCA induit des mutations géniques sur différents types de souches et cellules, que cela soit in vitro (en présence d’un activateur métabolique) ou in vivo. Elle est aussi à l’origine de mutations génomiques in vitro. Des résultats équivoques sont obtenus concernant les mutations chromosomiques in vivo (micronoyaux). Des adduits à l’ADN ont été mis en évidence, notamment au niveau des hépatocytes et des cellules de l’épithélium de l’arbre urinaire. Par ailleurs, les essais de transformation cellulaire réalisés sur cellules rénales de hamsters s’avèrent positifs.
In vitro, la MOCA induit des révertants dans les souches TA 98 et TA 100 de S. typhimurium, dans plus d'une dizaine de tests d’Ames. Toutefois, la mutagénicité de la MOCA n'apparaît qu’en présence d’activation métabolique[17, 30]. Les métabolites mono- et di-acétylés de la MOCA sont également mutagènes dans ce test, mais l'effet est moins marqué qu'avec le produit inchangé [17].
La MOCA induit également des mutations dans des cultures de levures (S. cerevisiae) et des cellules de mammifères (fibroblastes de rats) [17].
L'induction de la réparation de l'ADN par la MOCA a également été étudiée in vitro sur des cultures de cellules Hela et d'hépatocytes de rats, de souris, de hamsters et de lapins. Le test s’est avéré positif dans tous les cas [17].
La MOCA est à l’origine de foyers de transformation cellulaire dans des cellules rénales de jeunes hamsters en culture (BHK). Des résultats équivoques ont été obtenus dans le cas d’échanges de chromatides-sœurs[36]. Si aucune aberration chromosomique n’est observée avec des cellules CHO[17], elles ont été plus récemment mises en évidence sur des fibroblastes, en présence de S9[30].
In vivo, les tests recherchant un effet génotoxique sont moins nombreux :
- la MOCA s'est révélée faiblement mutagène chez Drosophila melanogaster,
- les résultats obtenus dans le test des micronoyaux, chez la souris (moelle osseuse), sont contradictoires[17].
La liaison de la MOCA à l'ADN a été démontrée in vitro et in vivo. Des adduits à l'ADN des hépatocytes, à l'hémoglobine et à l'albumine plasmatique ont été mis en évidence chez des rats exposés à la MOCA marquée [17].
La liaison à l'ADN des cellules de l'épithélium de l'arbre urinaire a été démontrée in vitro sur des cultures de cellules vésicales humaines et de chien. Trois adduits différents de la MOCA à l'ADN d'hépatocytes de rats ont été caractérisés : deux d'entre eux seulement sont acétylés. Le 3e, le plus important, a été identifié : il s’agit de l'alcool N-(déoxyadénosin 8-yl)-4-amino-3-chlorobenzylique.
Effets cancérogènes [15, 17, 37]
La MOCA est cancérogène. Chez le rat, elle est à l’origine d’adénocarcinomes pulmonaires et hépatocellulaires, de tumeurs mammaires et des glandes de Zymbal, et d’hémangiosarcomes. Chez la souris, des adénocarcinomes hépatocellulaires et des hémangiosarcomes sont observés. Chez le chien, les tumeurs sont localisées au niveau de la vessie et de l’urètre.
Des rats ont reçu 1 000 mg/kg de MOCA dans leur alimentation, à faible teneur en protides, pendant 71 semaines. La dose totale administrée était en moyenne de 27 g/kg poids corporel. L'incidence des adénocarcinomes pulmonaires et des tumeurs hépatiques bénignes et malignes est augmentée dans le groupe traité [37, 38].
Dans une étude semblable (rat, 1 000 mg/kg dans l'alimentation, pendant 78-80 semaines), d'autres auteurs ont également constaté une augmentation de l'incidence des tumeurs bénignes et malignes pulmonaires (adénocarcinomes et carcinomes à cellules squameuses) et hépatiques (carcinomes). En outre, ils ont observé une fréquence plus élevée de tumeurs mammaires (fibroadénomes et adénocarcinomes) et quelques cas de mésothéliome pleural chez les femelles exposées [34, 37].
Dans une troisième expérimentation, les rats ont reçu pendant 18 mois 0, 250, 500 ou 1 000 mg/kg de MOCA dans leur alimentation normale ou 0, 125, 250 ou 500 mg/kg avec un régime hypoprotéïque. L'incidence des cancers est augmentée dans tous les groupes traités, de manière dose dépendante. Les tumeurs les plus fréquentes sont des adénocarcinomes pulmonaires ; les fréquences des adénocarcinomes hépatocellulaires, des tumeurs des glandes de Zymbal et des hémangiosarcomes sont également élevées. Celle des tumeurs mammaires n'est augmentée que chez les animaux dont la ration proteïque est normale [37, 39].
Chez des souris recevant 1 000 ou 2 000 mg/kg de MOCA dans leur alimentation pendant toute leur vie, l'incidence des hémangiosarcomes (témoins : 0/18 ; faible dose : 3/13 ; forte dose : 8/20) et des adénocarcinomes hépatocellulaires (témoins : 0/20 ; faible dose : 9/21 ; forte dose : 7/14) augmente de manière dose dépendante [37, 40].
Chez le chien ayant reçu 100 mg/j de MOCA, 5 ou 7 jours par semaine pendant 9 ans, l'incidence des tumeurs de l'arbre urinaire (vessie et urètre) est augmentée [35, 37].
Comme pour la voie orale, l'injection sous-cutanée répétée de MOCA pendant 620 jours (dose totale : 25 g/kg) est à l'origine de tumeurs hépatiques et pulmonaires chez le rat [37, 41].
Aucune étude n'est disponible par inhalation.
Effets sur la reproduction [30]
La MOCA n’a pas d’effet sur la reproduction ou le développement.
Lors d'une étude combinée toxicité chronique/reprotoxicité, des rats ont été exposés par gavage à 0-0,4-2-10-50 mg/kg/j de MOCA pendant 42 jours pour les mâles ou 42 à 55 jours pour les femelles. Aucun effet sur les paramètres de la reproduction (notamment la durée de l'œstrus, le nombre d'accouplements, l'indice de fertilité, la durée de la gestation, le nombre de corps jaunes ou le nombre de nouveau-nés vivants) ou sur le développement des nouveau-nés (sexe-ratio, poids moyen des nouveau-nés, malformation ou indice de viabilité) n'a été observé. La dose sans effet est de 50 mg/kg/jour.
-
Toxicité sur l’Homme
Il existe peu de données humaines. L’exposition aiguë à la MOCA entraine probablement la formation de méthémoglobine et une hémolyse. Deux cas anciens décrivent des symptômes urinaires, des irritations oculaires et digestives ont également été rapportées. Une étude de génotoxicité est positive. Les données disponibles ne permettent pas d’évaluer la cancérogénicité de la MOCA pour l’Homme. Le CIRC l’a classée dans le groupe 1 (agent cancérogène pour l’Homme). Aucune donnée sur les effets sur la reproduction n’est disponible.
Toxicité aiguë
Les données disponibles sont très peu nombreuses. En 1965, deux cas de pollakiurie et d'hématurie ont été rapportés chez six travailleurs exposés à la MOCA pour la production de polyuréthanes. Les troubles ont régressé à l'arrêt de l'exposition [42].
En 1978, un ouvrier qui avait eu une contamination cutanée étendue par la MOCA et en avait ingéré un peu s'est plaint d'épigastralgies et d'une conjonctivite. Biologiquement, la seule anomalie a été une protéinurie transitoire. La concentration urinaire de MOCA était de 1 400 µg/g de créatinine à la 5e heure, de 30 µg/g de créatinine à la 23e heure [43].
Enfin, en 1990, un cas de contamination cutanée étendue par la MOCA a été rapporté [44]. Aucun effet clinique ou biologique n'a été constaté. Cependant la concentration urinaire de l'amine était élevée : 1 700 µg/L (2 169 µg/g de créatinine) à la 4e heure et sa demi-vie d'élimination était d'environ 23 heures.
Par analogie avec d'autres amines aromatiques, il est habituel d'indiquer que la MOCA est probablement méthémoglobinisante et hémolysante. De même, en raison de sa proximité structurale avec le 4,4'-diaminodiphénylméthane, des effets hépatotoxiques sont attendus. En pratique, cependant, il n'a jamais été rapporté d'anomalies hépatiques ou érythrocytaires chez l'animal ou dans les populations humaines exposées.
Irritation
Des signes d'irritation oculaire (conjonctivite) et digestive modérés après une contamination du visage et une ingestion accidentelles ont été signalés [43] ; les effets ont été réversibles.
Sensibilisation
Il n'existe pas de données disponibles.
Effets génotoxiques
Douze salariés exposés à de la MOCA dans une usine de production de polyuréthane ont été soumis à une recherche de micronoyaux dans des cellules urothéliales et sanguines prélevées en milieu de semaine de travail. Ces résultats ont été comparés à ceux de 18 sujets non exposés. La fréquence de micronoyaux était plus élevée dans les cellules urothéliales et les lymphocytes des sujets exposés (14,27 ± 0,56 et 13,25 ± 0,48) que chez les témoins (6,90 ± 0,18 et 9,24 ± 0,29 MN/1 000 cellules) [45].
Effets cancérogènes
En 1971, aucun cas de tumeur de l'arbre urinaire n'avait été observé chez 178 travailleurs qui avaient été en contact avec la MOCA mais dont l'exposition était interrompue depuis plus de 10 ans [46]. De même, il n'a pas été noté de tumeur de la vessie chez 31 ouvriers toujours actifs et dont l'exposition était de 6 mois à 16 ans. Ces données ne permettent pas d'évaluer la cancérogénicité de la MOCA car la cohorte est de petite dimension, l'exposition est mal caractérisée et de trop brève durée ; de plus, l'incidence de cancers de la vessie chez les salariés ayant quitté l'usine n'a pas été évaluée.
Au cours d'une étude systématique de 540 salariés exposés à la MOCA dans une usine chimique, des taux anormaux de MOCA dans les urines des salariés ont été signalés [47, 48] ; le suivi par examen cytologique ou cystoscopie (pour certains salariés) a permis de dépister deux cas de tumeurs de la vessie chez des sujets de moins de 30 ans et non fumeurs, un troisième cas a été dépisté ultérieurement chez un fumeur.
Enfin, dans un article plus récent, une tumeur de la vessie a été dépistée, par cystoscopie, chez un salarié de 52 ans ayant été exposé pendant 14 ans à de la MOCA. Ce sujet n'était pas fumeur et ne prenait pas de traitement [49].
-
Interférences métaboliques
-
Cohérence des réponses biologiques chez l'homme et l'animal
