Pathologie - Toxicologie
-
Toxicocinétique - Métabolisme
En fonction de leurs caractéristiques dimensionnelles, les fibres d’amiante peuvent se déposer par sédimentation, par impaction aux bifurcations bronchiques ou par interception de l'extrémité de la fibre avec la paroi bronchique. Une fois déposées, les fibres d’amiante sont partiellement éliminées du poumon par les clairances mucociliaire, alvéolaire, interstitielle ou lymphatique. La plupart des fibres déposées dans les régions nasopharyngées et trachéo-bronchiques sont avalées ou expectorées.
Une partie des fibres déposées dans l'espace alvéolaire subit un transfert vers l’interstitium pulmonaire ; elles peuvent atteindre la plèvre ou être éliminées de l'interstitium via le système lymphatique et pénétrer dans les capillaires pour être distribuées vers différents organes et tissus (translocation).
Les nombreux mécanismes d’élimination impliqués (ex. dissolution partielle, phagocytose par différentes cellules, transport via l’ascenseur muco-ciliaire, scission longitudinale en fibrilles élémentaires, cassure transversale) dépendent des propriétés physico-chimiques intrinsèques des fibres ainsi que de leur diversité granulométrique.
Chez l'Homme
Les données biométrologiques sur la dissémination des fibres inhalées dans l'organisme par voies transpleurale, lymphatique et/ou systémique et leur rétention dans des sites extrapulmonaires sont peu nombreuses [24]. Les fibres peuvent interagir avec les cellules épithéliales pulmonaires, pénétrer dans l'interstitium pulmonaire puis atteindre la plèvre et le péritoine ainsi que des sites plus éloignés (translocation). Les fibres peuvent migrer dans les ganglions lymphatiques pulmonaires, dans les reins, le foie, l’urine. Cette migration peut atteindre le foetus des femmes enceintes exposées [23] : des fibres d’amiante ont été retrouvées dans des échantillons de placenta et de tissus d'enfants mort-nés [10].
- Dépôt
Un des sites préférentiels de dépôt des fibres d’amiante chez l’homme se situe au niveau des aires proches des bifurcations bronchiques. La région alvéolaire est accessible aux fibres dont le diamètre aérodynamique (Dae) est inférieur à 10 μm. Le Dae étant égal à environ trois fois le diamètre géométrique (diamètre dimensionnel), les fibres d’amiante d’un diamètre géométrique inférieur à 3 µm sont susceptibles d’atteindre la région alvéolaire [26] même avec des longueurs allant de 100 à 200 μm [25, 26].
Dans le tissu pulmonaire chez l’homme, les caractéristiques granulométriques des fibres sont fortement dépendantes du type de fibre : « Les analyses montrent de façon consistante que les diamètres moyens des fibres de chrysotile et de crocidolite sont rarement supérieurs à 0,2 µm, ce qui indique un pourcentage de fibres fines d'amiante (FFA) très élevé. La gradation du diamètre des fibres nues et des fibres centrales de corps asbestosiques (ie. fibres longues) en fonction du type d'amiante suit, dans la majorité des études, la séquence : chrysotile < crocidolite < amosite < trémolite < anthophyllite » [10].
- Clairance, biopersistance
La clairance des fibres d’amiante et leur biopersistance sont considérées comme les facteurs les plus importants pour l'évaluation des risques des maladies malignes et non malignes (fibrose et cancer) [27]. Il a en effet été démontré que le risque cancérogène augmente proportionnellement avec la charge en fibres d'amiante des poumons, et que l'étendue des plaques pleurales est associée au nombre de fibres dans le tissu pulmonaire.
La biopersistance pulmonaire des fibres dépend de différents facteurs (taille des fibres, composition chimique, stabilité physico-chimique…) [28]. Le premier facteur est la taille des fibres : après leur dépôt dans les voies respiratoires distales et les alvéoles, les fibres courtes sont plus facilement phagocytées par les macrophages alvéolaires que les fibres longues d’où leur demi-vie de rétention plus courte. Les fibres qui ne sont pas efficacement éliminées ou altérées par un processus physico-chimique sont dites biopersistantes. La composition chimique et la stabilité physico-chimique des fibres sont deux autres facteurs : le milieu biologique peut solubiliser les fibres et/ou les casser en fibres plus petites. Des dépôts de fer et de protéines peuvent charger la surface de la fibre, en particulier sur les fibres longues, comme en témoigne l'apparition de corps asbestosiques et entraîner une modification des propriétés de surface. A noter que, chez l’homme, ces corps asbestosiques, qui résultent d’un phénomène d’engainement de la fibre par un dépôt d’hémosidérine, ont été retrouvés dans des organes autres que le poumon dont les reins, le foie, la rate et le pancréas [29, 23].
Les amphiboles (crocidolite, trémolite) présentent une biopersistance plus importante que le chrysotile du fait de leur clairance pulmonaire plus lente [17] : la demi-vie des fibres dans le poumon s'établit en années pour les amphiboles et en mois pour les fibres de chrysotile [30]. En conséquence, une faible concentration pulmonaire en fibres de chrysotile ne permet pas d'exclure une exposition antérieure significative. Les fibres de chrysotile de longueur > 10 µm présenteraient une demi-vie de 8 ans [10]. Une étude longitudinale récente sur des données de patients présentant des pathologies liées à l’amiante (tumeurs, épanchements pleuraux, fibroses) a permis de confirmer la très grande biopersistance des fibres d’amphibole mais aussi de chrysotile [27] .
A dose totale identique, des différences de demi-vie et d’effets biologiques sont susceptibles de survenir lors d’une exposition à des pics de pollution intermittents par rapport à une exposition continue [31], ces pics pourraient dépasser les capacités d’épuration du poumon ou induire une plus grande pénétration alvéolaire des fibres d’amiante et par conséquent conduire à des effets physiopathologiques différents.
-
Mode d'actions
Mécanismes de toxicité et effets cellulaires
- Mécanismes de toxicité
Les mécanismes de la cancérogenèse et de la fibrose induits par l’exposition à l’amiante ne sont pas complètement compris. Les études expérimentales in vitro et in vivo ont permis d’identifier les déterminants principaux de la pathogénicité des fibres d’amiante à l’origine des effets cellulaires : la dimension des fibres et le rapport L/D, les propriétés de surface, les caractéristiques physico-chimiques, la surface spécifique, la composition chimique, la concentration d’exposition atmosphérique au cours du temps et la dose (charge pulmonaire).
Des données chiffrées permettent de mieux comprendre la complexité des facteurs physico-chimiques à l’origine des mécanismes de toxicité [31] :
► de 3 -15 m2/g de la crocidolite au 50 m2/g de chrysotile ;
► composition chimique : chrysotile (avec peu de variations suivant les gisements), amphiboles (plus complexe et plus variable que le chrysotile) ;
► résistance variable aux acides, la crocidolite étant plus résistante que l'amosite.
- Dimension et forme
Les particules les plus susceptibles d’être déposées dans le poumon profond ont un Dae moyen inférieur à 3 μm ; des fibres même avec des longueurs de plusieurs dizaines de microns peuvent aussi atteindre les alvéoles pulmonaires. Les fibres de longueur inférieure à 20 µm sont phagocytées (internalisation) par les macrophages et les cellules épithéliales (bronchiques, alvéolaires et mésothéliales), entrainant une stimulation de la réponse cellulaire au stress ainsi que des perturbations de la mitose des cellules. Les effets biologiques (tels que apoptose, lésions oxydatives de l'ADN, ruptures d'ADN et induction de l'expression de proto-oncogènes) des amiantes sous forme de fibres sont plus importants que ceux des minéraux de composition chimique similaire et sous forme de particules non fibreuses [28].
De nombreuses études démontrent que des effets toxiques plus importants se produisent avec des fibres plus longues ou des rapports L/d plus élevés. Cependant, le potentiel cancérogène des fibres d’amiante de faible rapport L/d (fibres « courtes », FCA) ne peut être exclu ; les FCA sont aussi susceptibles de provoquer une inflammation aiguë ou une fibrose si l’exposition est suffisante (excédant les capacités d’épuration pulmonaire).
Les macrophages et les polynucléaires qui ne peuvent pas facilement phagocyter les fibres longues de plus de 20 µm (phénomène dit de la « phagocytose frustée » ou limitée) relarguent des cytokines et des oxydants dans le milieu extracellulaire. Ces derniers provoquent à terme une inflammation chronique à l’origine de prolifération cellulaire, de génotoxicité, de synthèse et de libération de facteurs de croissance susceptibles de conduire à une fibrose, un épanchement pleural et au mésothéliome [22]. Les fibres longues et épaisses d’amiante déposées dans les poumons peuvent être encapsulées pour former des corps asbestosiques.
Le rôle de la taille des fibres en fonction des trois principales pathologies liées à l'amiante semble être différent [32] :
- l'asbestose est plus corrélée avec la surface des fibres retenues, bien que la fibrose corrèle également avec les fibres de plus de 2 μm ;
- le mésothéliome est mieux relié au nombre de fibres de longueur > 5 μm et de diamètre < 0,1 μm;
- le cancer du poumon avec des fibres de longueur > 10 µm et de diamètre > 0,15 µm.
- Plusieurs études, cependant, rapportent la présence de fibres très courtes dans les tissus pulmonaires et pleuraux des patients atteints de mésothéliome malin, suggérant de ne pas exclure le rôle des fibres courtes (< 5 μm) dans le développement des maladies liées à l'amiante.
- Propriétés de surface
Les caractéristiques physico-chimiques de surface des fibres influencent leur réactivité dans les milieux biologiques. De nombreux travaux ont porté sur leurs propriétés oxydo-réductrices susceptibles de catalyser des réactions et de générer des oxydants et des radicaux libres (espèces réactives de l’oxygène, ERO).
Les radicaux libres peuvent oxyder les macromolécules biologiques et induire des lésions de l’ADN (avec un effet potentiel clastogène ou mutagène), des lipides ou des protéines ainsi que des dysfonctionnements cellulaires.
- Composition chimique
La composition chimique des fibres intervient dans leur cinétique de dissolution dans le milieu pulmonaire : le chrysotile est moins biopersistant que les amphiboles, en particulier aux pH acides. Les études de biométrologie ont montré que le chrysotile est moins fréquemment retrouvé dans les poumons que les amphiboles après un long délai post-exposition.
- Autre
Indépendamment de leur composition chimique, les fibres aéroportées biopersistantes peuvent provoquer des maladies pleurales chroniques, ainsi qu’une fibrose pulmonaire et des cancers du poumon [33] mais avec des différences en terme de cibles et d’effets :
- Toutes les variétés d’amphiboles sont suffisamment biopersistantes pour être considérées comme hautement toxiques et les différences observées dans leur capacité à produire des réponses pulmonaires et pleurales dépendent en premier lieu de leur distribution en termes de longueur et de diamètre ;
- Les fibres de chrysotile seraient potentiellement moins toxiques que les amphiboles en raison de leur plus grande solubilité in vivo qui conduit à leur dissolution et à des cassures selon la longueur (raccourcissement) mais le CIRC a estimé que cela n’impliquait pas nécessairement un potentiel cancérogène plus faible que celui des amphiboles [32]. Les fibres de chrysotile aéroportées sont souvent plus longues que les autres fibres d'amiante (> 20 μm) : ces fibres subissent une défibrillation et sont un facteur causal important pour la fibrose pulmonaire et le cancer du poumon chez l’homme et l’animal par inhalation chronique.
- Effets cellulaires [32, 34 à 37]
Les effets de l’amiante sont la conséquence de deux types d’interaction : entre les cellules inflammatoires et les cellules mésothéliales et entre les fibres et les cellules conduisant à une stimulation de la prolifération des cellules épithéliales bronchiques, interstitielles pulmonaires et mésothéliales. Le mésothéliome malin résulterait de l'effet direct des fibres d’amiante sur les cellules mésothéliales. L’asbestose (fibrose pulmonaire interstitielle) est la conséquence de la synthèse d’une grande quantité de matrice extracellulaire induit par un cycle d’altération du tissu pulmonaire suivi par sa réparation et lié à l’inflammation chronique.
Les caractéristiques physico-chimiques des fibres influencent fortement les effets inflammatoires et fibrogènes des différents types d'amiante in vitro et in vivo. Les fibres inhalées sont épurées par les macrophages si elles sont assez courtes. Cependant, si la dose en fibres est trop importante ou si les fibres sont longues, elles peuvent se transloquer dans l'espace pleural et exercer des effets toxiques sur les pneumocytes et les cellules mésothéliales. Ces cellules produisent alors une variété de médiateurs comprenant des espèces réactives de l’oxygène (ERO), des cytokines et des facteurs de croissance qui conduisent à des lésions cellulaires, de l'inflammation, des dommages à l'ADN et la stimulation de la croissance et de la prolifération cellulaires conduisant à la fibrose ou à la cancérogenèse. Les échantillons d'amiante présentant de fortes proportions de particules ou de fibres courtes contribuent significativement à l'inflammation aiguë, tandis que les fibres plus longues semblent nécessaires pour la fibrose à long terme et les effets néoplasiques [38].
Différentes cellules immunitaires interviennent dans la réponse pulmonaire à l’exposition à l’amiante dont les macrophages alvéolaires (MA) et les lymphocytes NK (Natural Killer). Les MA qui sont les principales cellules qui phagocytent l'amiante dans les poumons déclencheraient la chaîne des événements menant à la fibrose pulmonaire chronique (asbestose) et au cancer du poumon. Les résultats concernant les fonctions des cellules NK [36] démontrent la présence d’un effet immunosuppresseur de l'amiante sur l'immunité antitumorale [39].
En conclusion, l'inhalation de fibres d'amiante longues et minces induit une réponse inflammatoire chronique aux sites de dépôt de fibres qui, avec le temps, peut conduire à une transformation cellulaire maligne. Trois principaux mécanismes contributeurs ont été proposés [40]:
- les cellules mésothéliales et les macrophages exposés aux fibres d'amiante génèrent des espèces réactives de l'oxygène (ERO) et des espèces réactives de l'azote (ERN), qui conduisent à des dommages à l'ADN ;
- les cellules mésothéliales et les macrophages exposés aux fibres d'amiante libèrent une variété de cytokines et de facteurs de croissance qui induisent l’inflammation et facilitent la transformation maligne des cellules mésothéliales dont l’ADN a été altéré.
- les fibres d’amiante peuvent adsorber des molécules chimiques (hydrocarbures aromatiques polycycliques, HAP), des métaux (fer…) et des macromolécules biologiques (protéines, acides nucléiques, phospholipides, immunoglobulines…) avec pour conséquence l'accumulation de molécules dangereuses, notamment des cancérogènes.
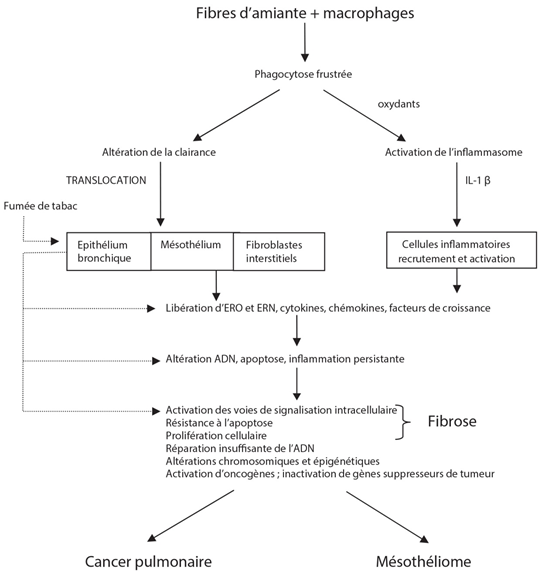
Figure 1 : Mécanisme de la cancérogénicité des fibres d’amiante [32].
-
Toxicité expérimentale
Toxicité expérimentale
L’exposition aux fibres d’amiante est associée au développement de pathologies non-malignes des poumons et de la plèvre, ainsi qu'aux pathologies malignes du poumon, du larynx et des membranes pleurales et péritonéales. La toxicité expérimentale a essentiellement apporté des informations sur l’influence des paramètres dimensionnels des fibres sur la toxicité ainsi que des éléments comparatifs entre les divers types d’amiante.
L'inhalation étant la principale voie d'exposition chez l’homme aux fibres minérales en général et à l’amiante en particulier, seuls les résultats des études expérimentales effectuées par inhalation ont été retenus ici. De nombreuses études expérimentales in vitro et in vivo chez l’animal (rat principalement) démontrent le caractère génotoxique et cancérogène des fibres d’amiante. Les effets sont modulés notamment par la taille et la forme des fibres, leurs caractéristiques de surface et leur biopersistance.
Des rats ont été exposés à des concentrations égales en nombre de fibres de chrysotile de longueur supérieure à 5 µm, de crocidolite et d'amosite, toutes avec des diamètres médians d’environ 0,4 µm [41] ; le chrysotile dont le ratio de fibres longues était significativement plus élevé induisait des réponses fibrogènes et cancérogènes plus importantes que la crocidolite ou l'amosite. Une corrélation entre tumeurs pulmonaires et proportion de fibres > 20 µm a été retrouvée mais pas entre tumeurs pulmonaires et type de fibre. Par ailleurs, les fibres courtes d’amosite ne produisaient pratiquement aucune fibrose, alors que les fibres longues d’amosite étaient plus fibrogènes que le chrysotile [42]. Des conclusions similaires ont été tirées d'études par inhalation de fibres d'amosite, de barbes de carbure de silicium (SiC), de diverses fibres minérales vitreuses et fibres céramiques réfractaires chez des rats ; dans leur analyse, les principaux facteurs influençant les réponses biologiques étaient le nombre de fibres < 1,0 μm de diamètre et > 20 μm de longueur, ainsi que la vitesse de dissolution des fibres [43].
La fibrose (démontrée histopathologiquement chez l’animal) peut survenir si l'exposition est suffisamment longue (90 jours) et en particulier après la période initiale d’inhalation lorsque les animaux ont été mis en observation. La fibrose ne serait pas une condition préalable à la carcinogenèse. La prolifération des cellules épithéliales est un mécanisme de réparation après une lésion tissulaire, mais la prolifération excessive des cellules augmente la probabilité d’apparition de populations de cellules mutées ; elle est particulièrement préoccupante si elle persiste après la fin de l'exposition [44].
Effets génotoxiques
Le stress oxydatif induit par les radicaux libres est considéré comme l'un des principaux mécanismes des effets génotoxiques et mutagènes de l'amiante. Le mécanisme est soit direct par interaction physique avec les éléments intracellulaires impliqués dans la division cellulaire (après phagocytose par les cellules cibles), soit indirect en raison de l'altération de l'ADN et du chromosome par les espèces réactives de l'oxygène (ERO) et de l'azote (ERN). Ainsi, toutes propriétés physiques ou chimiques des fibres susceptibles d’affecter la capacité de génération d'ERO et ERN, ou de favoriser l'interférence physique avec les cellules mitotiques (teneur en fer de surface et dimension des fibres), affectent la mutagénicité des fibres [45].
La génotoxicité directe des fibres d'amiante via la synthèse d’ERO à la surface des fibres d'amiante a pour conséquences la formation de bases oxydées de l’ADN et des ruptures de brins d'ADN conduisant à des mutations géniques si elles ne sont pas correctement réparées. Il a également été démontré que les fibres d'amiante interfèrent physiquement avec l'appareil mitotique ce qui peut entraîner une aneuploïdie ou une polyploïdie et des altérations chromosomiques spécifiques caractéristiques du cancer lié à l'amiante.
La génotoxicité indirecte est provoquée par l'inflammation persistante et l’activation des macrophages alvéolaires ou péritonéaux pouvant générer secondairement des ERO et des ERN additionnelles [32, 46].
Les principaux déterminants de l’activité biologique des fibres d’amiante et de leur génotoxicité est fonction de différents paramètres [45] :
- la dimension des fibres : les fibres longues et fines provoquent le phénomène dit de la phagocytose frustrée des macrophages alvéolaires qui induit le relargage constant d’espèces réactives au potentiel génotoxique et mutagène. Elles interfèrent aussi avec la cytokinèse lors de la mitose pouvant conduire à une aneuploïdie des cellules filles.
- la présence de fer oxydable à la surface des fibres : elle est susceptible de catalyser des réactions conduisant à la synthèse des ERO. Les amphiboles présentent plus de fer sur leur surface que les serpentines. A concentrations similaires, les amphiboles (ie, crocidolite, amosite) produisent in vitro plus d’altérations de l’ADN : cassures double-brin, oxydation de bases nucléotidiques (8-OhdG) que le chrysotile.
- la surcharge pulmonaire en fibres : elle induit une réduction drastique de la clairance pulmonaire et une inflammation chronique ;
- la durabilité des fibres (plus ou moins longue biopersistance).
L’ensemble de ces facteurs, en plus d'induire une altération directe de l'ADN et une mutagénicité, conduit également à la libération prolongée de médiateurs inflammatoires et de facteurs de croissance, qui à leur tour régulent la fibrose et la transformation maligne induite par l'amiante.
En résumé :
- L’amiante est clairement mutagène dans différents modèles in vitro et in vivo et induit des mutations géniques et chromosomiques dans les cellules cibles par différents mécanismes (ie génération de ERO, interaction physique avec le fuseau mitotique).
- Des altérations génétiques et chromosomiques spécifiques sont retrouvées dans les tissus de mésothéliome chez l’homme en association avec l’exposition à l’amiante. Des profils de mutations similaires ont été identifiés dans des modèles de mésothéliomes murins.
- La mutagenèse ne joue pas de rôle dans le développement des plaques pleurales et dans l’épaississement pleural diffus, lesquels semblent être produits par des changements dans la régulation de gènes secondaires à la génération de ERO et l'inflammation.
Effets cancérogènes
Les expérimentations animales visant à étudier le potentiel cancérogène des fibres ont été réalisées principalement chez le rat et, à une bien moindre échelle, chez le hamster et la souris. Les animaux ont été exposés aux fibres selon différentes voies d’exposition: inhalation, instillation intratrachéale ou inoculation dans la cavité pleurale ou péritonéale.
Des carcinomes bronchiques et des mésothéliomes pleuraux ont été observés dans de nombreuses expériences par inhalation chez le rat exposé à des fibres de chrysotile, de crocidolite, d'amosite, d'anthophyllite et de trémolite. Dans ces études, il n'y avait pas d'augmentation concluante de l'incidence des tumeurs à d'autres sites que le poumon et la plèvre. Il est généralement considéré que le potentiel cancérogène de ces fibres augmente avec leur longueur. Ci-dessous quelques exemples d’études par inhalation basés sur la sélection opérée dans le rapport du CIRC [32].
Des rats (48 rats /groupe) ont été exposés au chrysotile (2 et 10 mg/m3), à la crocidolite (5 et10 mg/m3) ou à l'amosite (10 mg/m3) (7h/j, 5j/s, 224 jours). Les incidences de tumeurs (adénomes, carcinomes, mésothéliomes pleural et péritonéal) étaient : chrysotile (15/40 à 10 mg/m3 et 9/42 à 2 mg/ m3), crocidolite (1/43 à 10 mg/ m3 et 3/43 à 5 mg/ m3), amosite (2/43 à 10 mg/ m3). D’après les auteurs la plus forte proportion de tumeurs liée à l’exposition au chrysotile pouvait être expliquée par la proportion de fibres de plus de 20 μm dans la poussière de chrysotile utilisée (72 f/mL, pour 2mg/ m3) par rapport à la crocidolite (17 f/mL, pour 5mg/ m3) et à l’amosite (6 f/mL, pour 10 mg/ m3). En plus des tumeurs pulmonaires, un nombre relativement important de tumeurs extrapulmonaires du tissu conjonctif péritonéal était observé[42].
Des rats mâles et femelles (20 rats/groupe et par sexe) ont été exposés à 10 mg/ m3 d'érionite, 7 heures par jour (h/j) , 5 jours par semaine (j/s) pendant 12 mois. Vingt-sept rats sur 28 ont développé des mésothéliomes pleuraux. Aucune tumeur pulmonaire n'a été observée [47].
Des rats mâles ont été exposés à la crocidolite : 10 mg/ m3 (1610 fibres OMS/mL (> 5µm] contenant 236 fibres > 20 μm), 6 h par jour, 5 jours par semaine. L’exposition a été arrêtée après 10 mois en raison d'une mortalité inattendue interprétée comme un dépassement de la dose maximale tolérée. Quatorze rats sur 106 (13,2%), qui ont survécu à la deuxième année ou plus, sont décédés d'une tumeur pulmonaire (cinq de ces rats ont développé un carcinome pulmonaire) et un rat a également développé un mésothéliome. Dans le groupe témoin, 2/126 rats ont développé des adénomes pulmonaires [48].
Des hamsters dorés mâles (n=125) ont été exposés à des concentrations de 0,8, 3,7 ou 7,1 mg/ m3 d'amosite 6 heures par jour, 5 jours par semaine, pendant 78 semaines suivie de 6 semaines sans exposition. Parmi les animaux ayant survécu pendant au moins 32 semaines, les mésothéliomes pleuraux ont été respectivement de 3/83, 22/85 et 17/87. Aucun mésothéliome n'a été observé chez 83 témoins non traités et aucune tumeur pulmonaire n'a été observée dans aucun groupe [49].
Pour les autres voies d’exposition, des échantillons des six types d'amiante ont été administrés à des rats par injections intrapleurale ou intrapéritonéale dans de nombreuses études [32]. De manière constante, l'induction du mésothéliome a été observée lorsque les échantillons contenaient un nombre suffisant de fibres de longueur > 5 µm. Seules quelques études ont été menées par instillation intratrachéale de crocidolite chez le rat et le hamster avec des tumeurs pulmonaires malignes observées chez le rat et des mésothéliomes pleuraux et des tumeurs pulmonaires malignes chez le hamster. Le chrysolite, la crocidolite et l'amosite administrés dans l'alimentation des rats et des hamsters n’ont pas entrainé d’augmentation de l'incidence des tumeurs gastro-intestinales.
Synthèse des mécanismes de cancérogénèse
La cancérogenèse est un processus en plusieurs étapes. Les fibres d’amiante peuvent initier un événement génotoxique ; elles ont aussi un rôle dans l'activation de la promotion tumorale, événement non génotoxique impliquant la prolifération cellulaire chronique [50, 51].
Les mécanismes de cancérogenèse liés aux fibres d’amiante ne sont pas actuellement totalement élucidés, mais la convergence générale des résultats expérimentaux et épidémiologiques permet de proposer une séquence d’événements. En particulier, une séquence d'événements susceptible de conduire au développement du mésothéliome malin diffus a été proposée dans la revue générale de Lippmann [33] sur la base d’une analyse des données expérimentales publiées :
- Pénétration de fibres de diamètre < 0,1 μm à travers les épithéliums pulmonaires qui atteignent la plèvre ou le péritoine par drainage lymphatique ;
- Rétention des fibres fines de longueur supérieure à 5 μm dans les stomates de la plèvre pariétale ;
- Libération d’espèces réactives de l’oxygène (stress oxydant) qui provoque une lésion aiguë de la monocouche de cellules mésothéliales tapissant les espaces pleuraux ou péritonéaux ;
- Réparation de la lésion aiguë de la muqueuse mésothéliale par la prolifération de cellules mésothéliales adjacentes non lésées ;
- Interaction directe des fibres d'amiante avec la population de cellules mésothéliales en régénération pouvant provoquer des aberrations chromosomiques et l'aneuploïdie. Des dommages supplémentaires à l'ADN peuvent être produits par des espèces réactives de l'oxygène formées par catalyse à la surface de la fibre.
- Amorçage et activation de l'inflammasome NLRP3 par des fibres de crocidolite, conduisant à la libération de cytokines proinflammatoires (IL-1 β, IL-6, IL-8) et du facteur de croissance de l’endothélium vasculaire (VEGF).
- Emergence d'une sous-population de cellules à prolifération autonome secondaire à des épisodes répétés de lésions et de régénérations des cellules mésothéliales.
- Production de facteurs de croissance favorisant la croissance d'une tumeur invasive par les cellules mésothéliales néoplasiques.
La notion de fibres pathogènes définies comme des fibres « suffisamment longues, minces et biopersistantes » a fait l'objet de nombreux débats ainsi que les différences dans les relations exposition-réponse (ou dose interne-réponse) des fibres d'amiante chez l'homme et chez le rat. Il en est de même des différences potentielles de cancérogénicité du chrysotile comparé aux amiantes amphiboles ; la biopersistance plus élevée pour le groupe des amphiboles peut expliquer cette différence. Font également débat, les extrapolations des relations exposition-réponse à partir des résultats d’anciennes études par inhalation : souvent réalisées à de fortes concentrations elles doivent être interprétées avec prudence, car les effets observés peuvent avoir été influencés par une surcharge de la capacité de clairance [33].
Fibres d’amiante asbestiforme courtes (FCA) , fines (FFA) et fragments de clivage
Dans sa revue générale, Lippmann [33] déduisait de la littérature que les risques liés à l’inhalation des fibres minérales tels que l'asbestose, le mésothéliome et le cancer du poumon, étaient associés à des fibres dont les longueurs dépassent des valeurs critiques (cf. supra). Il existerait aussi différents diamètres critiques des fibres : pour l'asbestose et le cancer du poumon, les plus étroitement liés aux fibres retenues dans les poumons, seules les fibres ayant un diamètre supérieur à 0,15 μm seraient critiques ; pour le mésothéliome qui est initié par les fibres qui migrent des poumons vers la plèvre et le péritoine, le risque pourrait être lié à des fibres de diamètre inférieur plus facilement éliminées par voie de drainage lymphatique.
Les fibres d’amiante courtes (FCA) et fines (FFA) se différencient par les critères dimensionnels suivants : FCA (0,5 µm < L < 5 µm, d < 3 µm et L/D ≥ 3), FFA (L ≥ 5 µm, d < 0,2 µm et L/d ≥ 3).
Les fragments de clivage sont des fibres (L/d > 3 ; d < 3 μm) de longueur L > 5 μm ou courtes L < 5 μm, provenant des homologues non fibreux des amiantes.
Il est important de noter que des paramètres autres que dimensionnels, tels que réactivité de surface ou composition chimique, impliqués dans le potentiel toxique des différentes amiantes concernent toutes les classes granulométriques.
Si les FCA sont intrinsèquement moins pathogènes que les fibres longues d’amiante (FLA), il est clair que la pathogénicité des FCA ne peut pas être complètement exclue, en particulier dans des situations à forte exposition. Cette différence d’effets démontrés repose principalement sur les études expérimentales du fait que peu d'études épidémiologiques ont pris en compte les FCA. D’après les données humaines, l'exposition à des fibres longues et fines serait associée à des taux plus élevés de cancers du poumon, mais aucune conclusion définitive ne peut être déterminée pour les autres classes de taille. Dans les études expérimentales, les différences proviennent d'études comparatives entre les effets des échantillons d'amiante de différentes longueurs moyennes ou différentes distributions en taille : la puissance fibrogène ou cancérogène des FCA est moindre que celle des FLA. Cependant, les FCA à fortes doses peuvent provoquer une inflammation, une fibrose pulmonaire interstitielle et des réactions pleurales [28]. Ces éléments amènent à conclure que les fibres longues et fines semblent plus toxiques que les fibres courtes dont la clairance est plus rapide [32].
Concernant les fragments de clivage, l’ANSES concluait [5] :
- que les études épidémiologiques ne permettent pas d’exclure un risque pour la santé lié à l’exposition aux fragments de clivage issus des variétés non asbestiformes des cinq amphiboles réglementaires ;
- qu’il existe un lien entre l’exposition de populations à certaines amphiboles calciques ou calco-sodiques présentes sous forme de mélange de différents faciès (telles que la fluoroédénite, la winchite ou la richtérite), et la survenue de cancers ;
- qu’il n’existe aucune donnée toxicologique scientifiquement validée permettant d’affirmer que les fragments de clivage répondant aux critères dimensionnels des fibres « OMS » (L > 5 μm ; d < 3 μm et L/d > 3) sont moins toxiques que leurs homologues asbestiformes.
Effets sur la reproduction
La reprotoxicité potentielle de l’amiante est peu documentée.
Un passage transplacentaire a été décrit après ingestion (gavage) chez la souris (chrysotile)[52] et après injection intraveineuse chez le rat (chrysotile) [53] et la souris (crocidolite) [54].
Chez la souris, l’ingestion d’amiante (chrysotile) via l’eau de boisson pendant la grossesse n’a pas montré d’augmentation de l’incidence des malformations [55].
Chez la souris CD1, une augmentation significative de l’incidence des malformations externes et squelettiques (réduction des membres, fusion vertébrale) a été décrit après injection unique (crocidolite, amosite, chrysotile) par voie intra péritonéale à J9 de la gestation par rapport à un groupe contrôle [56].
-
Toxicité sur l’Homme
Toutes les formes d’amiante sont cancérogènes pour l’Homme. L’exposition à l’amiante peut entraîner des mésothéliomes malins, des cancers broncho-pulmonaires, des cancers du larynx, des cancers de l'ovaire. Une association positive a également été observée entre l’exposition à l’amiante et le cancer du pharynx, de l’estomac, du colorectum. L’exposition à l’amiante peut être responsable de pathologies pleuropulmonaires non malignes comme les plaques pleurales, l’asbestose, la pleurésie bénigne, la fibrose de la plèvre viscérale.
Toxicité chronique
Pathologies pleuro pulmonaires non malignes
Plaques pleurales
Il s’agit de plages circonscrites de tissu conjonctif, riches en collagène, pauvres en cellules, recouvertes de cellules mésothéliales normales. Elles touchent presque exclusivement la plèvre pariétale. Elles sont le plus souvent bilatérales et asymétriques [57 à 59]. Typiquement, elles siègent au niveau de la paroi thoracique antéro latérale du 3ème au 5ème espace intercostal (EIC), de la paroi thoracique postéro latérale dans la gouttière costo diaphragmatique à partir du 6ème EIC, des sommets des coupoles diaphragmatiques [60].
- Epidémiologie
Les plaques pleurales sont la plus fréquente des pathologies liées à l’inhalation de fibres d’amiante[58, 59]. Les plaques pleurales apparaissent en général plus de 15 ans après le début de l’exposition à l’amiante. « Le temps écoulé depuis le début de l’exposition à l’amiante et l’exposition cumulée sont deux variables significativement et indépendamment associées à la prévalence des plaques pleurales. Il n’existe aucun seuil démontrable de durée ou d’intensité minimale d’exposition aux fibres d’amiante pour cette pathologie » [61]. En dehors de l’amiante, d’autres causes de plaques pleurales sont évoquées comme les fibres céramiques réfractaires, l’érionite, la fluoro édénite [57, 62, 63]. Le rôle du tabac dans l’apparition de plaque pleurale est controversé [57].
- Clinique
Les plaques pleurales sont généralement asymptomatiques [59]. Leur retentissement sur la fonction respiratoire est discuté dans la littérature, certaines études rapportent des altérations de la fonction respiratoire (comme une diminution de la capacité vitale forcée) [64 à 66].
- Diagnostic
Le diagnostic est porté à l’imagerie. La tomodensitométrie thoracique (TDM) est plus sensible et spécifique que la radiographie thoracique pour la détection de plaques pleurales [57]. C’est actuellement l’examen de référence pour le diagnostic des pathologies pleuropulmonaires non malignes associées à une exposition à l’amiante [66]. Les plaques pleurales se reconnaissent à leurs bords nets et abrupts, donnant un aspect de surélévation quadrangulaire en plateau, de densité tissulaire voire calcifiée [57, 59, 60].
- Evolution
« L’évolution la plus habituelle, après une période d’augmentation en taille et /ou en étendue, est une stabilisation avec éventuellement une calcification progressive »[57]. Le lien entre la présence de plaques pleurales et le sur-risque de cancer chez les sujets antérieurement exposés à l’amiante fait débat. Les plaques pleurales ont longtemps été considérées comme des marqueurs de l’exposition à l’amiante indépendantes du risque de cancer, mais des études récentes remettent en question ce postulat. Une association forte entre plaques pleurales et mortalité par mésothéliome a été identifiée dans le programme de surveillance multirégional français ARDCO (Asbestos-Related Diseases Cohort) ainsi qu’une association (moins prononcée) entre plaques pleurales et mortalité par cancer broncho-pulmonaire [67 à 69].
Asbestose
L’asbestose est la fibrose pulmonaire secondaire à l’inhalation d’amiante ; c’est une pneumoconiose.
- Epidémiologie
La prévalence de l’asbestose semble en diminution dans les pays industrialisés. Une prévalence inférieure à 10 % a été rapportée dans des populations exposées étudiées par TDM thoracique [61]. La latence entre le début de l’exposition et les premières anomalies cliniques ou radiologiques est généralement d’une vingtaine d’années, mais peut être plus courte pour des expositions intenses [57]. « Il existe une relation dose-effet entre le niveau d’exposition cumulée à l’amiante, la fréquence et la sévérité de l’asbestose » [61]. L’asbestose est rare pour des niveaux d’exposition inférieurs au seuil de 25 f/mL années y compris en ayant recours à la TDM thoracique [61, 70] . Les possibles facteurs de susceptibilité individuelle restent mal connus [58]. L’influence du tabagisme sur la sévérité de l’asbestose est débattue [57, 58].
- Clinique
Initialement, l’asbestose peut être asymptomatique. Les signes cliniques ne sont pas spécifiques, ils peuvent s’observer dans d’autres pneumopathies interstielles. Les signes fonctionnels respiratoires peuvent comprendre une dyspnée progressive d’abord limitée à l’effort, une toux, voire des douleurs thoraciques inhabituelles, et dans les formes plus graves, une insuffisance respiratoire avec hypoxémie chronique, voire une insuffisance cardiaque droite [59]. Les signes physiques peuvent comprendre des râles crépitants prédominant aux bases pulmonaires pouvant s’étendre à l’ensemble du poumon avec l’évolution de la maladie, et de façon inconstante un hippocratisme digital dans les formes évoluées[58, 71, 72]. La fonction respiratoire peut être normale dans les formes initiales ou limitées. Puis, une diminution de la capacité de diffusion du monoxyde de carbone peut être observée, ainsi qu’un trouble ventilatoire restrictif [58, 71].
- Diagnostic
Le diagnostic d’asbestose repose sur un faisceaux d’arguments comprenant la confirmation d’anomalies compatibles à l’imagerie ou à l’histologie, la confirmation d’une exposition à l’amiante et l’absence de tout autre diagnostic [61].
Dans certains cas, d’autres éléments d’orientation diagnostique peuvent être recherchés comme [59, 73, 74] :
► La présence de corps asbestosiques au lavage broncho-alvéolaire (LBA) ou dans les expectorations.
► La présence de corps asbestosiques et/ou de fibres d’amiante à la biopsie.
- Imagerie
Les signes radiologiques ne sont pas spécifiques, ils peuvent être observés également dans d’autres pneumopathies interstitielles comme la fibrose pulmonaire idiopathique[57, 59]. Sur la radiographie thoracique standard, l’asbestose se caractérise par des opacités interstitielles irrégulières, accentuant la trame vasculaire pulmonaire et prédominant généralement aux bases pulmonaires. Puis avec l’aggravation, ces opacités deviennent plus denses et s’étendent généralement à la partie moyenne des champs pulmonaires, restant bilatérales et globalement symétriques [57]. Des images dites en « rayon de miel » peuvent être observées dans les formes sévères. Une classification internationale des radiographies de pneumoconiose a été proposée par le Bureau international du travail (BIT) pour standardiser la lecture des clichés à des fins épidémiologiques[57, 75].
La TDM thoracique est un outil diagnostique plus sensible et spécifique que la radiographie thoracique [57]. Les lésions prédominent généralement au niveau postérobasal et périphérique. Les lésions élémentaires suggestives comprennent des micronodules centrolobulaires (et opacités branchées) sous pleuraux, des lignes courbes sous pleurales, des hyperdensités en verre dépoli, des bronchectasies de traction, des images en rayon de miel. D’autres signes sont égalements rapportés comme des réticulations intralobulaires et des lignes septales [60].
Des anomalies pleurales non malignes (plaques pleurales...) peuvent être associées.
- Evolution
Les anomalies radiologiques peuvent continuer d’évoluer après l’arrêt de l’exposition à l’amiante, particulièrement lorsqu’il s’agit de fibres d’amphiboles[59]. La progression dépend des niveaux d’exposition passés[61]. À exposition cumulée identique à l’amiante, l’asbestose radiologique semble majorer le risque de cancer broncho-pulmonaire (CBP), surtout les formes rapidement évolutives d’asbestose. L’exposition à l’amiante augmente également le risque de CBP en l’absence d’asbestose[32, 61].
Pleurésie bénigne
Le diagnostic repose sur plusieurs critères, en particulier : une exposition documentée à l’amiante, l’absence d’autre cause identifiée de pleurésie, l’absence de malignité pleurale dans les 3 ans qui suivent la découverte de l’épanchement [59]. Le temps de latence moyen est de l’ordre de 30 ans, mais des latences de moins de 10 ans ont également été rapportées[57]. L’épanchement peut être uni ou bilatéral, il est généralement peu ou asymptomatique, parfois récidivant[57]. L’évolution peut se faire vers une régression spontanée, ou vers une fibrose de la plèvre viscérale [57, 58, 61].
Fibrose de la plèvre viscérale (ou épaississements pleuraux viscéraux)
La fibrose de la plèvre viscérale s’accompagne d’une symphyse des deux feuillets pleuraux[59]. Des adhérences entre la plèvre et la paroi thoracique sont souvent observées [61]. Elle constitue généralement une séquelle de pleurésie bénigne de l’amiante. Elle pourrait aussi résulter de l’extension d’une fibrose pulmonaire sous pleurale à la plèvre viscérale [61].
A la radiographie thoracique, la fibrose de la plèvre viscérale s’associe à un comblement du cul de sac diaphragmatique homolatéral [75].
A la TDM thoracique, la définition généralement retenue est un épaississement pleural, quelles qu’en soient l’étendue et l’épaisseur, associé à un retentissement parenchymateux à type de bandes parenchymateuses ou d’atélectasies par enroulement, situées au contact de l’épaississement [61]. Les épaississements pleuraux sont situées préférentiellement dans les régions postérieures et inférieures de la paroi thoracique [59].
La fibrose de la plèvre viscérale est moins fréquente que les plaques pleurales (4 à 10 fois moins selon les études) [61]. La prévalence varie en fonction de l’exposition cumulée et du temps écoulé depuis le début de l’exposition. Comme pour la pleurésie bénigne, le temps de latence moyen est de 30 ans, mais des latences plus courtes ont également été décrites dans le cas de fortes expositions (moins de 10 ans) [61]. Elle s’accompagne volontiers de douleur thoracique, voire d’altération de la fonction respiratoire (trouble ventilatoire restrictif)[57]. La fibrose de la plèvre viscérale semble résulter de niveaux d’exposition élevés, mais il n’a pas été identifié de seuil d’exposition en-dessous duquel le risque serait nul [61].
Effets cancérogènes
Dans la dernière évaluation de la cancérogénicité de l’amiante du CIRC, le groupe de travail conclut qu’il existe des preuves suffisantes chez l'Homme de la cancérogénicité de toutes les formes d'amiante (chrysotile, crocidolite, amosite, trémolite, actinolite et anthophyllite) (groupe 1). L'amiante provoque le cancer du poumon, le mésothéliome pleural et péritonéal, le cancer du larynx et de l'ovaire (niveau de preuve suffisant). Des associations positives ont également été observées entre l'exposition à toutes les formes d'amiante et le cancer du pharynx, de l'estomac et le cancer colorectal (niveau de preuve insuffisant) [76].
Cancer broncho-pulmonaire
Il peut s’agir de tout type histologique et de toutes localisations[57, 77].
- Epidémiologie
Des cas de cancers du poumon ont été rapportés chez des travailleurs atteints d’asbestose dès 1935 [32]. La première étude de cohorte ayant montré un excès de cancer du poumon chez des travailleurs exposés à l’amiante concernait l’industrie textile : 11 cas de cancer du poumon contre 0,8 attendus (p < 0,00001) sur la base des taux de mortalité nationaux. Depuis, une association entre cancer du poumon et exposition professionnelle à l'amiante a été trouvée dans de nombreuses études de cohortes et études cas-témoins dans diverses industries [11]. Si les données de la littérature sont en faveur d’une relation dose-effet, sa forme (linéaire ou non) reste controversée [78].
L’exposition à l’amiante est le principal facteur de risque professionnel connu de cancer broncho-pulmonaire [57].
En France, la part de cancer du poumon attribuable à une exposition professionnelle à l’amiante en 2012 a été estimée entre 5,9 % et 16,2 % chez les hommes (soit de 1670 à 4566 cas), et entre 0,9 % et 1,4 % chez les femmes (soit de 97 à 153 cas), selon le scenario retenu (respectivement, scenario 1 : toutes expositions non nulles et risque relatif (RR) le plus faible ; scenario 2 : exposition > 0,1 f/mL et RR le plus élevé) [79]
Dans une récente revue de la littérature (analysant 24 études de cohorte et 4 études cas-témoins), l’association entre l'exposition à l'amiante et le risque de cancer du poumon est décrite comme globalement linéaire avec une possible stabilisation pour des expositions élevées (> 150 f/mL.années). Une augmentation du risque relatif de 0,01 à 0,04 par f/mL.années est observée. Une estimation plus haute (doublement pour 4 f/mL.années) est rapportée dans une étude cas-témoins de bonne qualité. Il n’a pas été identifié de seuil d’exposition au-dessous duquel le risque de cancer du poumon serait nul (NOAEL) [77].
Le délai de survenue du cancer du poumon varie de 10 à plus de 20 ans[5].
Le risque de cancer du poumon est augmenté en cas d’exposition simultanée à l’amiante et au tabac, mais il est aussi établi chez les non-fumeurs [5]. Leur action cancérogène est synergique, la relation semble intermédiaire entre un modèle additif et multiplicatif [77, 80, 81].
Il existe des controverses sur la façon dont le risque peut varier en fonction des différents types d’amiante (chrysotile, amphibole), de la taille des fibres, ainsi que sur le risque pour de faibles niveaux d'exposition (expositions environnementales) [32].
Des facteurs de susceptibilité individuelle sont discutés dans la littérature.
- Diagnostic et imagerie
Il n’y a pas de particularité clinique, radiologique ou histologique qui le distingue d’un cancer broncho-pulmonaire d’autre origine [57].
Mésothéliome malin
Il s’agit d’une tumeur maligne, développée aux dépens des cellules qui tapissent les cavités séreuses [82]. La localisation initiale la plus fréquente est la plèvre, puis de façon moins fréquente, le péritoine et encore plus rarement, le péricarde ou la tunique vaginale testiculaire[5, 83].
- Epidémiologie
Le mésothéliome quelle que soit sa localisation est considéré comme un cancer rare (< 6/100 000 habitants selon la collaboration européenne Rare Cancer Europe) [84].
Le premier constat d'une association possible entre l'exposition à l'amiante et le mésothéliome est fait par Wagner et al. qui décrivent en 1960 des cas de mésothéliome dans une région minière de crocidolite en Afrique du Sud. Depuis, un excès de mésothéliomes a été observé dans un grand nombre d'études de cohorte et d’études cas-témoins dans diverses industries utilisant et produisant de l'amiante [32].
Le mésothéliome pleural malin survient après une longue période de latence pouvant atteindre 40 ans, voire plus ; elle est supérieure à 15 ans dans la quasi-totalité des cas [61, 71]. D’après les données épidémiologiques récentes, le risque de mésothéliome semble atteindre un plateau vers 40 ans après la première exposition[85]. L’impact du profil d’exposition à l’amiante (âge à la première exposition, importance de l’exposition en début de carrière) sur le risque de mésothéliome est discuté [85 à 87]. II n’a pas été identifié de seuil d’exposition en dessous duquel le risque d’apparition du mésothéliome pleural malin serait nul.
Bien que toutes les formes d'amiante puissent causer le mésothéliome, des données indiquent que le risque de survenue d'un mésothéliome varie selon le type de fibres, et notamment que l'amiante chrysotile est moins suceptible d’induire le mésothéliome que les formes amphiboles de l'amiante [32].
Le rôle du tabac dans la genèse du mésothéliome n'a pas été démontré [61, 71].
En dehors de l’amiante, d’autres facteurs étiologiques de mésothéliomes malins sont connus (érionite, fluoro édénite, métier de peintre [32]), ou suspectés (fibres céramiques réfractaires (FCR), radiations ionisantes, virus SV40).
En France, entre janvier 2012 et avril 2014, 1282 cas de mésothéliome incidents en 2012 et 2013 ont été notifiés (via le dispositif de déclaration obligatoire). Ils étaient localisés uniquement au niveau de la plèvre dans 85 % des cas (n=1134), uniquement au niveau du péritoine dans 8 % des cas (n=103), uniquement au niveau de la tunique vaginale testiculaire pour 3 cas, et uniquement au niveau du péricarde pour 1 cas. Une double localisation était observée pour 23 cas. Le sexe ratio était de 2,4 (71 % d’hommes n=908 vs 29 % femmes n=374). La localisation anatomique différait selon le sexe (p < 0,0001). L’âge moyen au diagnostic était de 73 ans pour les mésothéliomes pleuraux. Il était significativement moins élevé pour les mésothéliomes péritonéaux que pour les mésothéliomes pleuraux [69].
En France, la part de mésothéliome pleural attribuable à une exposition professionnelle à l’amiante en 2012 a été estimée (à partir des données du PNSM) entre 74,5 % et 91,7 % chez les hommes (soit de 603 à 743 cas), et entre 25,3 % et 58 % chez les femmes (soit de 75 à 172 cas), selon le scenario retenu (respectivement, scenario 1 : toutes expositions non nulles et RR le plus faible ; scenario 2 : exposition > 0,1 f/mL et RR le plus élevé) [79].
- Diagnostic
Les symptômes du mésothéliome pleural malin sont peu spécifiques et tardifs. Il peut s’agir de signes pulmonaires (dyspnée, douleur thoracique, toux, pleurésie…), voire plus tardivement de signes généraux (altération de l’état général, syndrome paranéoplasique…) [88, 89]. Le diagnostic de certitude est histologique, il s’aide de l’immunohistochimie [71]. L’histologie est définie par la nouvelle classification anatomopathologique de l’OMS de 2015 des tumeurs de la plèvre. Les mésothéliomes pleuraux malins diffus ou localisés sont subdivisés en quatre types histologiques : épithélioïdes (le plus fréquent), sarcomatoïdes, biphasiques ou mixtes (avec des contigents cellulaires épithélioïdes et sarcomatoïde), desmoplastiques [82].
De nombreux biomarqueurs sont à l’étude pour évaluer leur intérêt dans le diagnostic précoce de mésothéliome malin pleural. Aucun n’est encore recommandé de façon systématique [88, 89].
- Imagerie
Concernant le mésothéliome pleural malin, l’aspect typique à la TDM est celui d’un épaississement pleural circonférentiel (notamment de la plèvre médiastinale) avec rétraction de l’hémi-thorax [89].
Cancer du larynx
Dans la dernière évaluation de la cancérogénicité de l’amiante du CIRC, le groupe de travail retient une association causale entre l’exposition à l’amiante et le cancer du larynx (niveau de preuve suffisant) en s’appuyant sur l’analyse de 29 études de cohortes regroupant 35 populations, 15 études cas-témoins et une méta-analyse réalisée par l’Institute of Medicine en 2006. Les études de cohorte analysées par le groupe de travail montraient une association entre l’exposition à l’amiante et le cancer du larynx dans plusieurs industries (isolation, mines, textile, ciment…) [32].
Depuis la monographie du CIRC, plusieurs études s’intéressant à l’association entre cancer du larynx et exposition à l’amiante ont été publiées.
Parmi celles-ci, la revue systématique et méta analyse réalisée par Peng et al (à partir de 21 études de cohorte) retrouve une augmentation significative du taux de mortalité standardisé (SMR) pour le cancer du larynx chez les sujets exposés à l'amiante (SMR = 1,69 ; IC 95 % [1,45-1,97] ; p < 0,001). Une association significative entre l’exposition à l’amiante et la mortalité par cancer du larynx est observée chez les hommes mais pas chez les femmes (SMR = 1,71 ; IC 95 % [1,33-2,19] ; p < 0,001 versus SMR = 1,44 ; IC 95 % [0,90-2,29] ; p = 0,125). Des SMR plus élevés sont rapportés dans les cohortes menées en Europe et en Océanie, dans celles concernant les industries minières et textiles, dans celles ciblant l'exposition au crocidolite, dans celles dont le suivi est supérieur à 25 ans et dans celles où le SMR pour le cancer du poumon est supérieur à 2,0. Cette étude ne prend pas en compte les potentiels facteurs de confusion que sont l’alcool et le tabagisme [90].
Dans l’étude française ICARE (Investigations sur les cancers respiratoires et environnement) menée auprès de 448 cas comparés à 2686 témoins, l’odd-ratio (OR) pour le cancer du larynx augmente légèrement avec le niveau, la durée et la probabilité de l’exposition à l’amiante. Pour un niveau d’exposition cumulé (IEC) inférieur ou égal à 0,04 f/mL.années, l’OR est de 1,65 (IC 95 % [1,17-2,33]) ; pour un IEC compris entre 0,05 et 1,41 f/mL.années, l’OR est de 1,72 (IC 95 % [1,25-2,37]) ; et pour un IEC supérieur à 1,41 f/mL.années, l’OR est de 1,81 (IC 95 % [1,32-2,48]). D’autre part, l’OR est de 2,05 (IC 95 % [1,50-2,82]) chez les hommes dont la durée d’exposition est supérieure à 30 ans, et de 1,76 [1,24-2,50] chez les hommes dont la probabilité d’exposition est supérieure à 70 %. Les auteurs décrivent un effet additif entre l’exposition à l’amiante et la consommation d’alcool, et un effet supra additif entre l’exposition à l’amiante et la consommation de tabac [91].
En France, la part de cancer du larynx attribuable à une exposition professionnelle à l’amiante en 2012 a été estimée entre 5,9 % et 31 % chez les hommes (soit de 166 à 876 cas), et entre 0,8 % et 3,1 % chez les femmes (soit de 4 à 15 cas), selon le scenario retenu (respectivement, scenario 1 : toutes expositions non nulles et RR le plus faible ; scenario 2 : exposition > 0,1 f/mL et RR le plus élevé) [78].
Cancer de l’ovaire
Dans la dernière évaluation de la cancérogénicité de l’amiante du CIRC, le groupe de travail retient une association causale entre l'exposition à l'amiante et le cancer de l'ovaire (niveau de preuve suffisant), en s’appuyant notamment sur 5 études de cohortes fortement positives portant sur la mortalité de femmes exposées professionnellement à l'amiante [11]. Depuis la monographie du CIRC, plusieurs études s’intéressant à l’association entre cancer de l’ovaire et exposition à l’amiante ont été publiées. Parmi celles-ci, Pira et al. ont étudié la mortalité d’une cohorte de 1 083 femmes travaillant dans le textile et ayant eu une forte exposition à l'amiante (jusqu'à 100 f/mL). En 2016, les auteurs rapportent un SMR pour le cancer des ovaires de 3,03 (IC 95 % [1,69-4,99]) soit 15 décès [92].
Dans une revue de la littérature publiée en 2014, Bounin et al. analysent 17 études datant de 1960 à 2013. Les auteurs constatent pour toutes les études de cohorte analysées (sauf une étude finlandaise menée auprès de 167 femmes exposées à l’amiante anthophyllite sans cas de cancer de l’ovaire rapporté) une élévation du risque de cancer de l’ovaire lorsque les femmes ont été exposées professionnellement à l’amiante. Les auteurs soulignent toutefois les limites que peuvent présenter ces études notamment le faible nombre de cas de cancers de l’ovaire généralement observés au sein des cohortes, la présence non systématique d’une confirmation histologique du diagnostic (surtout pour les études anciennes), le peu d’informations sur les conditions d’expositions (comme le niveau d’exposition) et sur les autres facteurs de risque de cancer de l’ovaire [93].
Une méta-analyse portant sur 14 études de cohorte et 2 études cas-témoin estime un méta-RR à 1,75 (IC 95 % [1,45-2,1]), diminuant à 1,29 (IC 95 % [0,97-1,73]) quand seules les études disposant d’une confirmation diagnostique de cancer de l’ovaire sont considérées [94].
La méta-analyse de Camargo et al. portant sur 18 études de cohorte estime un SMR de 1,77 (IC 95 % [1,37‑2,28]). L'estimation est supérieure pour les cohortes menées en Europe, pour celles présentant une asbestose (avec réparation), et pour celles où le SMR pour le cancer du poumon est estimé à plus de 2,0 [69].
En France, la part de cancer de l’ovaire attribuable à une exposition professionnelle à l’amiante en 2012 a été estimée entre 1,6 % et 2,1 % chez les femmes (soit de 74 à 97 cas), selon le scenario retenu (respectivement, scenario 1 : toutes expositions non nulles et RR le plus faible ; scenario 2 : exposition > 0,1 f/mL et RR le plus élevé) [79].
Cancer de l'appareil digestif
Dans la dernière évaluation de la cancérogénicité de l’amiante du CIRC, le groupe de travail retient une association positive entre l'exposition à l'amiante et le cancer du pharynx, de l'estomac et le cancer colorectal (niveau de preuve insuffisant). Pour le cancer colorectal, le groupe de travail était divisé quant à savoir si les éléments de preuve étaient suffisants, la littérature suggérant par ailleurs une association plus forte pour le cancer du côlon que pour le cancer du rectum[32].
Depuis la monographie du CIRC, plusieurs études s’intéressant à l’association entre exposition à l’amiante et cancers digestifs (colorectal, pharynx, estomac, œsophage, foie, voies biliaires,…) ont été publiées. Certaines semblent apporter des indications supplémentaires de l’existence d’une relation entre exposition professionnelle à l’amiante et la survenue de cancers digestifs, particulièrement de cancers colorectaux. Parmi celles-ci, les études de Offermans et al. et Paris et al. sont des cohortes de grande taille avec un ajustement sur les facteurs de risque connus de cancers digestifs [76, 95, 96].
En 2017, l’ANSES a été saisie par la DGS concernant l’analyse d’articles scientifiques relatifs aux risques de cancers digestifs liés à l’ingestion d’amiante, notamment via l’eau. Dans leurs conclusions, les experts rapporteurs indiquent que les études analysées ne permettent pas de déterminer la contribution de l’ingestion dans l’apparition de ces cancers digestifs, ces études se basant sur l’inhalation. Compte tenu des incertitudes quant aux risques éventuels liés à l’ingestion d’eau contenant des fibres d’amiante, une autosaisine de l’ANSES sur cette question est prévue [76].
Effets sur la reproduction
La reprotoxicité potentielle de l’amiante est peu documentée (hors atteintes des organes de la reproduction comme le cancer de l’ovaire abordé dans le chapitre « Pathologies malignes »).
L’équipe américaine de Haque et al. a décrit au travers de plusieurs études la présence de fibres d’amiante dans des organes et/ou tissus (poumons, foie, muscles, placenta) de bébés morts-nés, mais aussi dans des placentas de bébés vivants [98 à 100]. Les auteurs ont suggéré la possibilité d’un passage transplacentaire des fibres d’amiante. En 1998, ces auteurs retrouvent une association significative entre la présence de fibres d’amiante dans des tissus de bébés morts-nés, des anomalies du placenta (comme l’infarctus, l’hématome, la chorioamniotite) (p=0,041) et des antécédents d’avortement chez la mère (p=0,007) [100].
-
Interférences métaboliques
-
Cohérence des réponses biologiques chez l'homme et l'animal
Les résultats des études chroniques par inhalation indiquent que les rats sont des modèles appropriés pour les maladies pulmonaires humaines induites par l'amiante, avec apparition d’une inflammation chronique, d'une fibrose pulmonaire, d'un cancer du poumon et d'un mésothéliome. Les hamsters semblent être plus sensibles que les rats au développement du mésothéliome, mais moins sensibles au développement des tumeurs pulmonaires [97].
D’après les résultats épidémiologiques, les fibres d'amphibole (notamment crocidolite et trémolite) sont plus souvent associées au mésothéliome et aux plaques pleurales que les fibres de chrysotile lesquelles sont plus souvent associées avec le cancer pulmonaire et l’asbestose. Ce résultat n'a pu être testé de manière adéquate dans les études par inhalation car le rat développe peu de mésothéliomes sur ses deux ans d’espérance de vie [33].
En terme de cohérence animal-homme, le rapport de l’Afsset de 2009 [10] mentionne que « la cohérence entre les études toxicologiques menées chez l’homme ou chez l’animal est plus qualitative que quantitative, et n’est pas nécessairement homogène entre organes cibles (par exemple le poumon et la plèvre). Ainsi, la sensibilité de l’homme au cancer du poumon provoqué par l’inhalation de fibres d’amiante a été estimée environ 100 à 200 fois plus élevée que chez le rat ; la concentration de fibres de crocidolite dans le poumon du rat lors d’une étude négative était plus de 1000 fois supérieure à la concentration médiane dans les poumons de travailleurs atteints de mésothéliome professionnellement exposés à l’amiante [10].
