Pathologie - Toxicologie
-
Toxicocinétique - Métabolisme [3]
Le B[a]P est absorbé par voie orale, pulmonaire et cutanée. Il est distribué largement dans l'organisme et métabolisé en de nombreux métabolites. L'excrétion se fait majoritairement par voie biliaire et plus faiblement urinaire.
Chez l'animal
Absorption
L’absorption du benzo[a]pyrène par voie orale est incomplète et est majorée en présence de graisses dans le tractus gastro-intestinal. Elle a été estimée à environ 40 % chez le rat (1 seule dose, 3-4 nmol), avec un effet de premier passage hépatique important [15]. Il apparaît dans les canaux lymphatiques thoraciques 3 à 4 heures après administration par sonde gastrique.
L’absorption à travers l’épithélium pulmonaire est rapide. Immédiatement après inhalation d’un aérosol de 3H-B[a]P (rat, 500 µg/l, 1 h, diamètre aérodynamique moyen 1-2 µm), des quantités significatives de molécules radiomarquées se retrouvent dans le tractus respiratoire supérieur et dans différents organes.
La pénétration cutanée, estimée à partir d’un modèle in vitro de peau animale, est de 10 % de la dose appliquée chez la souris, 1 à 3 % chez le lapin, le rat et 0,1 % chez le cobaye, 24 heures après l’application de 2,5 µg/cm2 de B[a]P radiomarqué sur des explants de peau [16].
In vivo, l’absorption cutanée dans l’acétone est de 51 % chez le singe rhésus (application de 10 ppm pendant 24 h).
Le B[a]P est absorbé par voie orale, pulmonaire ou cutanée. Après absorption, il est rapidement et largement distribué.
Il apparaît dans les canaux lymphatiques thoraciques 3 à 4 heures après administration intragastrique. L’absorption du B[a]P sur la muqueuse intestinale semble précéder une diffusion passive à travers la paroi.
L’absorption à travers l’épithélium pulmonaire est rapide. Immédiatement après inhalation d’un aérosol de 3H]-B[a]P (rat, 500 µg/l, 1 h, diamètre aérodynamique moyen 1-2 pm), des quantités significatives de molécules radiomarquées sont retrouvées dans le tractus respiratoire supérieur, les ganglions lymphatiques thoraciques, les reins et le foie; les concentrations dans le cerveau, les testicules et la rate sont plus faibles. La clairance pulmonaire est biphasique avec des demi-vies de 2 h et 25-56 h ; cette dernière est probablement due à la métabolisation du B[a]P et à la fixation des métabolites aux macromolécules. La majeure partie de la radioactivité est éliminée du foie et des reins en 24 h, mais elle reste constante dans le cerveau, la rate et les testicules. Le pic d’accumulation dans les intestins atteint son maximum entre 3 et 6 h après l’exposition et diminue rapidement [19].
La pénétration cutanée, in vitro, est de 10 % de la dose appliquée chez la souris, 1 à 3 % chez l’homme, le lapin, le rat et 0,1 % chez le cobaye ; elle augmente si le B[a]P est en solution dans l’acétone (95 % chez le rat, 43 % chez l’homme après 48 h) [20]. In vivo, l’absorption cutanée dans l’acétone est de 51 % chez le singe rhésus et 35-48 % chez le rat. Le B[a]P est métabolisé au niveau cutané. Après absorption cutanée de [14C]-B[a]P, on observe chez la souris une baisse biphasique de la radioactivité sanguine avec des demi-vies de 40 h et 104 h, toute la radioactivité étant éliminée dans les fèces en 16 jours.
Le B[a]P est stocké dans les tissus adipeux et mammaires.
Distribution
Immédiatement après inhalation d’un aérosol de 3H-B[a]P (rat, 500 µg/l, 1 h, diamètre aérodynamique moyen 1-2 µm), des quantités significatives de molécules radiomarquées sont retrouvées dans le tractus respiratoire supérieur, les ganglions lymphatiques thoraciques, les reins et le foie ; les concentrations dans le cerveau, les testicules et la rate sont plus faibles. La clairance pulmonaire est biphasique avec des demi-vies de 2 h et de 25-56 h ; cette dernière est probablement due à la métabolisation du B[a]P et à la fixation des métabolites aux macromolécules. La majeure partie de la radioactivité est éliminée du foie et des reins en 24 h, alors qu’elle reste stable dans le cerveau, la rate et les testicules pendant cette même période [17].
Après une absorption par voie orale (rat, 100 mg/kg pc), une forte concentration de B[a]P est mesurée au niveau du foie, 24 heures après l’exposition [18].
Le passage transplacentaire a été montré chez des rates gravides exposées par inhalation, des métabolites étant présents chez les petits jusqu’à 15 jours après l’exposition [19]. Chez le rat et la souris, les concentrations mesurées dans l’embryon sont deux fois moins élevées que celles mesurées chez la mère [3].
Métabolisme
Le métabolisme du B[a]P du rat est proche de celui de l’Homme. Les enzymes à cytochrome P450 des rongeurs diffèrent légèrement de celles humaines, avec uniquement des CYP1A1 présents chez le rat et la souris. Elles sont présentes dans tous les tissus des mammifères, y compris la peau avec, chez l’animal, le taux le plus élevé dans le foie.
Les adduits à l’ADN sont identiques chez l’Homme et l’animal [3]. Comme chez l’Homme, le BaP-7,8-dihydrodiol-9,10-époxyde est le métabolite le plus réactif ; il se fixe par liaison covalente aux macromolécules (désoxyguanosine de l’ADN, acides diaminés de l’hémoglobine ou de l’albumine) pour former des adduits. La quantité d’adduits formés in vitro est la plus élevée chez l’homme puis, par ordre décroissant, chez le hamster, le rat et la souris [20]. Chez le rat, après administration intrapéritonéale, la quantité la plus importante d’adduits à l’ADN se trouve dans les poumons ; elle est en corrélation avec la quantité d’adduits dans les leucocytes.
Schéma métabolique
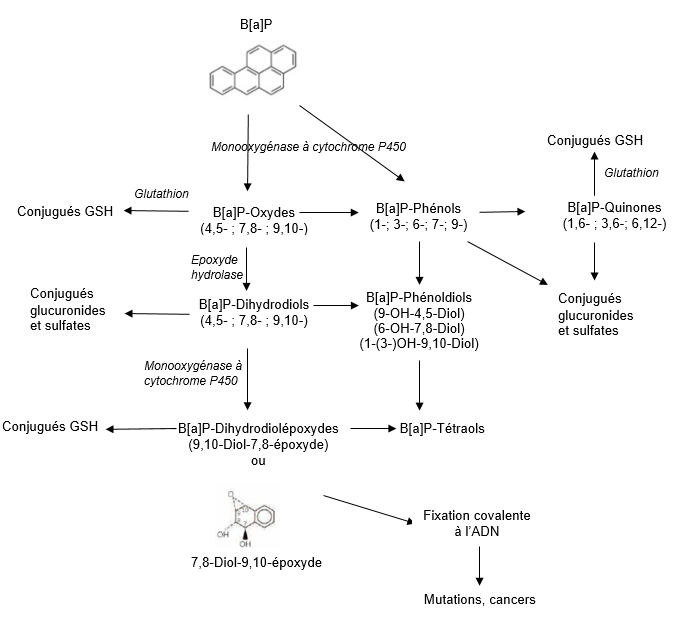
Excrétion
Le système hépatobiliaire et le tractus gastro-intestinal sont les voies principales d’élimination du B[a]P et de ses métabolites, quelle que soit la voie d’exposition. La forte excrétion fécale (70-75 % d’une dose sous-cutanée chez la souris) suggère l’existence d’un cycle entérohépatique.
L’excrétion urinaire est une voie mineure. Chez le rat et la souris, le maximum d’élimination se situe entre 24 et 48 h, la majeure partie de la dose urinaire totale étant excrétée en 72 h. Elle contient des métabolites du B[a]P conjugués sous forme de glucuronides, de sulfates et d’acides mercapturiques (> 80 % de la dose excrétée), des composés phénoliques et des esters, éthers et conjugués avec des sucres neutres (13-18 % de la dose excrétée) [21].
Après absorption cutanée de 14C-B[a]P, on observe chez la souris une baisse biphasique de la radioactivité sanguine avec des demi-vies de 40 h et 104 h, toute la radioactivité étant éliminée dans les fèces en 16 jours.
Il n’y a pas d’élimination dans l’air expiré.
Chez l'Homme
-
Absorption
Très peu de données sont disponibles chez l’Homme. Des études chez les salariés ont montré son absorption après une exposition par inhalation mais sans la quantifier. L’absorption serait rapide, dépendante de la taille des particules sur lesquelles le B[a]P est adsorbé.
Par voie orale, l’absorption est faible (non quantifiée) : elle dépend du véhicule dans lequel il est présent (présence de corps gras), du niveau d’acidité et de la présence d’aliments dans le tractus digestif [22].
Aucune donnée n’est disponible concernant le passage percutané du B[a]P in vivo. Cependant, il a pu être estimé à partir de données in vitro : 3 % après 24 heures sur de la peau humaine (dose récupérée dans le compartiment récepteur, après application de 2,5 µg/cm2 de B[a]P radiomarqué dans l’acétone), de 24 à 48 % après 48 heures (dose récupérée dans le compartiment récepteur + la peau, après application de 8 à 10 µg/cm2 dans l’acétone, biopsies réalisées sur des personnes plus ou moins âgées) [16, 23].
-
Distribution
Le B[a]P est rapidement distribué dans l’organisme et, du fait de sa forte liposolubilité, il s’accumule dans les glandes mammaires et les autres tissus riches en graisses. Il a été détecté dans le lait maternel, le placenta et le cordon ombilical [24].
-
Métabolisme (Cf schéma métabolique)
Le B[a]P peut être transformé en une vingtaine de métabolites oxydés et en un grand nombre de composés conjugués. Son métabolisme a lieu principalement dans le foie et se déroule en plusieurs phases.
L’oxydation initiale est effectuée par une monooxygénase à cytochrome P450 (CYP) qui entraine la formation de métabolites électrophiles et d’époxydes. Cette superfamille d’enzymes microsomiales est présente dans tous les tissus des mammifères, y compris la peau [25]. L’époxyde hydrolase, contenue dans la fraction microsomiale de nombreux organes et tissus (foie, testicules, ovaires, poumons, reins, peau, intestins, rate, thymus, cerveau et coeur) hydrolyse les époxydes pour former des dihydrodiols, qui sont oxydés à leur tour par une monooxygénase à cytochrome P450 en dihydrodiol-époxydes.
La seconde phase est une phase de conjugaison qui fait intervenir différentes enzymes capables de conjuguer la majorité des métabolites formés avec le glutathion, l’acide glucuronique ou un groupement sulfate. Cette conjugaison a pour objectif d’augmenter la solubilité des métabolites dans l’eau et ainsi de faciliter leur élimination via les urines et les fèces [26, 27].
Les enzymes humaines à cytochrome P450 diffèrent de celles des rongeurs [20]. Cependant, les métabolites formés dans les cellules ou les explants tissulaires humains sont identiques à ceux formés chez l’animal [28]. Ces enzymes sont inductibles par les HAP.
Le métabolite le plus réactif formé est le BaP-7,8-dihydrodiol-9,10-époxyde (BPDE) qui se fixe de façon covalente aux macromolécules (désoxyguanosine de l’ADN, acides diaminés de l’hémoglobine ou de l’albumine) pour former des adduits. La quantité d’adduits formés in vitro est plus élevée chez l’homme que chez les rongeurs [20]. Les adduits à l’ADN sont encore détectables 56 jours après la fin de l’exposition ; leur quantité varie selon les individus, en fonction des habitudes alimentaires, des habitudes tabagiques et du polymorphisme génétique [29].
Le benzo[a]pyrène est inducteur de son propre métabolisme en jouant le rôle tant d’inducteur que de substrat des enzymes prenant en charge sa propre biotransformation [3]. Le passage des hydrocarbures aromatiques polycycliques dans le cytoplasme entraîne une induction spécifique de certaines enzymes métabolisant les xénobiotiques. En effet, un récepteur cytoplasmique très spécifique des HAP, « l’aryl hydrocarbon receptor » (AhR) est lié à diverses protéines cytoplasmiques telles que les « Heat shock protein 90 » (Hsp90) et les « AhR interacting protein » (AIP). L’association entre l’AhR, Hsp90 et l’AIP confère au récepteur cytoplasmique une stabilité dans le cytoplasme assurant la reconnaissance spécifique et optimale vis-à-vis de certains ligands et notamment les HAP dont le benzo[a]pyrène. Il est maintenant établi que la liaison du benzo[a]pyrène au récepteur AhR est déterminante dans l’activation de la transcription des gènes codant pour les enzymes de phase I et de phase II [28].
-
Elimination
Le benzo[a]pyrène et ses métabolites sont principalement éliminés dans les fèces (70 à 75 %). Seuls 4 à 12 % sont éliminés par voie urinaire où l’élimination se fait à 80 % sous la forme de métabolites (métabolites polaires et dérivés phénoliques) et très faiblement sous la forme de benzo[a]pyrène non métabolisé.
Surveillance Biologique de l'exposition
Le dosage du 3-hydroxybenzo[a]pyrène urinaire (3-OHBaP), métabolite du B[a]P, est proposé pour la surveillance biologique des travailleurs exposés à des mélanges d'HAP contenant du B[a]P.
Compte tenu du décalage moyen de 16 heures entre la fin d'exposition et le maximum d'excrétion du 3-OHBaP, le prélèvement doit être réalisé au début du poste suivant (pour évaluer l’exposition de la journée précédente) ou au début de poste en fin de semaine (pour prendre en compte l’accumulation au cours de la semaine de travail). Un prélèvement au début de poste en début de semaine peut être utile pour estimer le niveau de base, après 48 heures sans exposition professionnelle.
Des valeurs biologiques d’interprétation professionnelles et issues de la population générale sont disponibles pour cet indicateur [30].
Le tabagisme et l’alimentation (consommation d’aliments grillés au barbecue ou fumés) notamment sont à prendre en compte dans l’interprétation des résultats.
-
-
Mode d'actions
-
Toxicité expérimentale
Toxicité aiguë [3]
Les effets aigus ont été peu étudiés car discrets. On note néanmoins des atteintes hépatiques et hématologiques. Il est légèrement irritant pour la peau.
Le B[a]P est peu toxique par voie orale, avec des DL50 supérieures à 1600 mg/kg chez la souris [31].
Administré dans la nourriture (0,1 %), il provoque, chez le rat ou la souris, un retard de croissance. Chez le rat, l’administration d’une dose unique de benzo[a]pyrène (0, 100, 600 ou 1000 mg/kg) a provoqué au bout de 2 semaines une augmentation significative dose-dépendante du poids relatif du foie (plus de 30 %), sans altération histologique associée ; l’augmentation de poids était plus marquée chez les mâles que chez les femelles [32]. Des signes hématologiques ont également été rapportés chez les mâles (baisse significative des globules blancs aux deux plus fortes doses), confirmant les effets immunosuppresseurs du benzo[a]pyrène décrits lors d’expositions chroniques.
Chez le rat, la DL50 est de 50 mg/kg par voie sous-cutanée.
- Irritation, sensibilisation
Une irritation légère est observée chez la souris dans les conditions du test de Draize. L’application de B[a]P (0,02 ml solution à 1 % dans l’acétone, 2 fois/j, 4 j) sur la zone interscapulaire induit une hyperplasie de l’épiderme chez la souris et, quelquefois, la destruction des glandes sébacées cutanées.
Le B[a]P, fixé sur des protéines cutanées du cobaye, peut induire, chez cet animal, une hypersensibilité cutanée retardée après sensibilisation préalable par application sur la peau ou injection dans le coussinet plantaire [33].
Toxicité subchronique, chronique
L'ingestion répétée provoque une atteinte de l'état général ainsi qu'une aplasie médullaire mortelle sur certaines souches animales.
Le B[a]P administré dans la nourriture (120 mg/kg/j) à des souches de souris pendant 6 mois induit, chez certaines d’entre elles, une perte de poids, une pancytopénie (anémie aplasique, thrombopénie et leucopénie) et la mort en 4 semaines. Ce même traitement n’a aucun effet pour d’autres souches. La mort semble être due à une hypoplasie médullaire ayant pour conséquences des hémorragies et des infections. Les différences de sensibilité à l’effet toxique du B[a]P seraient dues au polymorphisme génétique au niveau du locus « Ah » qui détermine l’inductibilité de l’enzyme d’oxydation [28].
Chez le rat, des effets rénaux, hépatiques et immunotoxiques/hématologiques ont été rapportés, les mâles étant plus sensibles que les femelles (Tableau 1).
Exposition
Effets rapportés
Référence bibliographique
Mâles
Femelles
0-3-10-30 mg/kg pc/j, gavage
5 j/sem, 3 mois
A partir de 10 mg/kg pc/j :
↑ poids du foie, sans lésion histologique associée ou modification de paramètres biologiques (ALAT, gamma GT, LDH)
30 mg/kg pc/j : légère atrophie du thymus
30 mg/kg pc/j :
↑ poids du foie, sans lésion histologique associée ou modification de paramètres biologiques (ALAT, gamma GT, LDH)
↓ poids du thymus
0-3-10-30-90 mg/kg pc/j, gavage
5 j/sem, 35 jours
A partir de 3 mg/kg pc/j : ↓ poids des reins
A partir de 10 mg/kg pc/j : ↓ poids du thymus ; ↓ nombre d’érythrocytes, des taux d’hématocrite et d’hémoglobine
90 mg/kg pc/j : ↑ poids du foie (avec hyperplasie des hépatocytes) ; ↓ nombre de lymphocytes dans la rate et des immunoglobulines A sériques
Injections sous-cutanées de 0,1 à 10 mg/kg
A partir de 1 mg/kg : ↓ érythropoïèse
0-5-50-100 mg/kg pc/j, via la nourriture 90 jours
A partir 50 mg/kg pc/j : lésions tubulaires rénales (80 à 100 % des animaux) ; ↓ nombre d’érythrocytes et de l’hématocrite
100 mg/kg pc/j : ↓ poids corporel et ↑ poids du foie ; ↓ taux d’hémoglobine
A partir 50 mg/kg pc/j : lésions tubulaires rénales (10 % des animaux)
100 mg/kg pc/j : ↓ nombre d’érythrocytes, hématocrite et hémoglobine
(↑ : augmentation ; ↓ : diminution)
Tableau 1. Synthèse des effets rénaux, hépatiques et immunotoxiques/hématologiques du B[a]P.
L’absence de myélotoxicité a été observée chez des souris déficientes en récepteur AhR, après une exposition à 120 mg/kg pc/j pendant 6 mois [37].
L’inhalation de 7,7 mg/m3 de benzo[a]pyrène (0,75 ppm, 2 h/j, 5 j/sem, pendant 4 semaines) n’induit aucun effet chez le rat au niveau pulmonaire, nasal ou rénal [38].
L’application quotidienne sur la peau de souris de 16-32 ou 64 µg de B[a]P pendant 29 semaines entraine, localement à la plus forte dose, la mort des cellules épidermiques puis une régénération, se traduisant par une légère augmentation de l’épaisseur de l’épiderme [39].
Le B[a]P peut initier et/ou promouvoir le processus athérogène dans les espèces aviaires et chez la souris Ah-sensible. L’initiation impliquerait une mutation des cellules musculaires par formation d’adduits avec l’ADN, alors que la promotion impliquerait un effet sur la prolifération cellulaire par augmentation de la transcription des gènes responsables de la croissance cellulaire après fixation sur des récepteurs spécifiques, et par interaction avec la protéine kinase C et son inactivation.
Effets génotoxiques [3, 28]
Le B[a]P est génotoxique dans des tests in vitro et in vivo.
-
In vitro
Le B[a]P est métabolisé en réactifs électrophiles capables de se fixer de façon covalente à l’ADN. Il a été utilisé comme témoin positif dans de nombreux tests in vitro : réparation de l’ADN bactérien et induction de bactériophages, mutations dans les bactéries, Drosophila melanogaster et les cellules de mammifère en culture. Dans ces dernières, il se fixe à l’ADN et provoque sa réparation, augmente le taux d’échanges entre chromatides sœurs, d’aberrations chromosomiques et de transformations cellulaires.
Le B[a]P influence aussi la méthylation de l’ADN (mécanisme épigénétique) [40].
-
In vivo
Le B[a]P se fixe à l’ADN et augmente le taux des échanges entre chromatides sœurs (moelle osseuse du hamster chinois et foie du hamster syrien), des aberrations chromosomiques dans la moelle osseuse du rat et des anomalies spermatiques. Il entraîne la formation de micronoyaux pour les doses allant de 62,5 à 500 mg/kg. Le test de mutation dominante létale et le spot test (une dose de 10 mg/kg) donnent des résultats positifs chez la souris. En revanche, les résultats sont négatifs pour le test du locus spécifique, ce qui pourrait indiquer une induction de fractures chromosomiques dans les cellules méiotiques et post-méiotiques mais pas de mutation des cellules souches (spermatogonies).
Le B[a]P est classé Mutagène de catégorie 1B par l’Union européenne.
Effets cancérogènes [28, 41]
Le B[a]P est un cancérogène local et systémique pour de nombreuses espèces animales quelle que soit la voie d’administration : inhalatoire, orale, cutanée et intratrachéale, et même par injection et par exposition transplacentaire.
Le B[a]P a été classé cancérogène catégorie 1B au niveau de l'Union européenne et appartient au groupe 1 du CIRC, agents cancérogènes pour l'Homme.
Dans son évaluation, le CIRC mentionne que le benzo[a]pyrène est pléiotrope, il possède ainsi la capacité d'affecter de nombreux systèmes cellulaires et de nombreux organes. In vivo, de nombreux modes d'action cancérigènes sont probablement impliqués, à des degrés divers : mécanismes via les récepteurs AhR, stress oxydant, immunotoxicité et événements épigénétiques.
Les preuves expérimentales solides et étendues de la cancérogénicité du benzo[a]pyrène chez de nombreuses espèces animales, étayées par des preuves mécanistiques cohérentes et constantes issues d'études expérimentales et humaines, soutiennent la classification globale du benzo[a]pyrène comme cancérogène pour l'Homme (groupe 1).
Chez les rongeurs, le B[a]P est à l’origine de tumeurs aux sites d’injection ou au niveau des nombreux organes comme les voies respiratoires, l’appareil digestif ou les glandes mammaires [41, Cf Tableau 2].
Systèmes
Organes
Espèces
Exposition
Voies respiratoires supérieures
Nez, larynx
langue
Hamster mâle
Souris femelle
Inhalation
Voie orale
Voies respiratoires inférieures
poumon
Souris
Rat, hamster, singe
Injections SC ou IP, exposition prénatale
Instillations intra-trachéales
Appareil digestif
Œsophage, pré-estomac
Intestin
foie
Hamsters mâles
Souris et hamsters
Hamsters
Souris mâles
Inhalation
Voie orale
Voie orale
Exposition prénatale, injections IP
Glande mammaire
Rats femelles
Voie orale et IV
Peau
Souris
Rats, souris, lapins
Prénatale
Voie cutanée
Système lymphatique (lymphomes)
Souris
Souris transgénique
IP
Voie orale
Tableau 2. Localisation des tumeurs observées dans les études en fonction des espèces et des voies d’administration (SC : sous-cutanée ; IP : intra-péritonéale ; IV : intraveineuse) [41]
Le B[a]P agit comme initiateur et comme promoteur ; une exposition continue ne serait pas nécessaire pour que les cellules initiées deviennent des tumeurs, cependant, la présence de B[a]P est nécessaire pour la transformation en néoplasme [42]. Le cancérogène final serait le métabolite BaP-7,8-dihydrodiol-9,10-époxyde [3, 43].
Effets sur la reproduction [3, 43]
Le B[a]P entraîne des atteintes des organes de la reproduction chez les femelles et les mâles, par voie orale et par inhalation. Il traverse la barrière placentaire du rat et de la souris et provoque une embryo- et fœto-létalité. Par voie orale, des effets sur le développement des nouveau-nés et des atteintes neurologiques sont aussi rapportés.
Fertilité
Système reproducteur mâle
Par voie orale, le B[a]P a de multiples effets sur le système reproducteur mâle des rongeurs comme la baisse de la qualité du sperme ou des changements histologiques au niveau des testicules et des épididymes.
La baisse de la qualité du sperme se traduit par :
- une diminution du nombre de spermatozoïdes (souris, 1 mg/kg pc/j, gavage, 42 jours ; rat, 5 mg/kg pc/j, gavage, 84 jours)[44, 45] ;
- une diminution de la motilité des spermatozoïdes (souris, 1 mg/kg pc/j, gavage, 42 jours ; rat, 0,01 mg/kg pc/j, gavage 90 jours) [45, 46] ;
- une augmentation du nombre de spermatozoïdes anormaux (souris, 50 et 100 mg/kg pc/j, gavage pendant 60 jours ; rat, 5 mg/kg pc/j, gavage pendant 84 jours) [46, 47].
Dans ces mêmes études, différentes atteintes testiculaires ont été constatées. Chez la souris, le poids des testicules a été diminué et le diamètre des tubes séminifères réduit (100 mg/kg pc/j) [47], une diminution du nombre de tubes séminifères contenant des spermatides allongées a été observée (1 et 10 mg/kg pc/j) [45]. Au niveau cellulaire, on a reporté une augmentation du nombre de cellules en apoptose (rat, 0,001 mg/kg pc/j), une perte de cellules de Sertoli (souris, 50 mg/kg pc/j), un réarrangement irrégulier des cellules germinales et une absence de spermatocytes (rat, 5 mg/kg pc/j).
Une diminution du diamètre des canaux épididymaires a aussi été mesurée chez le rat (0,001 mg/kg pc/j).
Des effets similaires ont été rapportés par inhalation. L’instillation de 75 μg/m3 (4 h/j, pendant 60 jours chez le rat) a provoqué une baisse du poids des testicules, de la lumière et du diamètre des tubes séminifères, de la production journalière de spermatozoïdes et de leur motilité ; en revanche, le pourcentage de spermatozoïdes anormaux a augmenté [48, 49].
Système reproducteur femelle
Plusieurs études ont mis en évidence des effets sur la fertilité, tels qu’une diminution du nombre de follicules et par là-même de la fécondité.
Chez la souris femelle chez laquelle on a administré tous les 2 jours pendant 60 jours une dose de 5 et 10 mg/kg pc/j (par gavage), le B[a]P a induit une diminution du poids des ovaires et du nombre des follicules primordiaux, une augmentation de la durée des cycles œstraux et du nombre de cellules folliculaires en apoptose [50]. Dans une étude plus ancienne, le nombre de souris avec des portées viables a diminué chez les femelles exposées à la plus forte dose (gavage, 160 mg/kg pc/j, GD7 à GD16) 51].
Au niveau du col de l’utérus, l’incidence des hyperplasies et de l’inflammation des cellules épithéliales a été augmentée chez des souris exposées à 5 et 10 mg/kg pc/j (gavage, 2 j/sem, 98 jours) [52].
Par inhalation, l’ovulation a diminué à 100 µg/m3 (rats femelles exposées 14 jours avant l’accouplement) [53].
Les atteintes sur les systèmes reproducteurs mâle et femelle pourraient résulter, entre autres, de dommages à l’ADN des cellules germinales, d’une altération de la fonction des cellules de Sertoli et de Leydig, des atteintes de la stéroïdogénèse ou d’un stress oxydatif [43].
Leur caractère trans-générationnel a été mis en évidence chez la souris dans plusieurs études. Une baisse du nombre de spermatozoïdes a été observée dans les générations F1 et F2 non exposées au B[a]P, seules les souris F0 ayant été exposées à 1 mg/kg pc/j de B[a]P pendant 42 jours [45]. De même, la génération F1, issue de souris exposées 10 jours pendant la gestation (10-40-160 mg/kg pc/j par voie orale), a été accouplée à des mâles non exposés : une diminution de la fertilité et de la taille des portées chez la génération F1 a été observée dès 10 mg/kg pc/j [54].
Développement
Les études disponibles par voie orale ont mis en évidence des effets sur les générations F1 et F2, au niveau de leur croissance et de leur capacité à se reproduire à leur tour (Cf. tableau 3).
Espèces
Exposition
Effets sur les mères F0 et les générations F1/F2
Référence bibliographique
Souris
F0 : 0-10-40 ou 160 mg/kg pc/j, GD7 à GD16, gavage
F1 : accouplement avec animaux non exposés
≥ 10 mg/kg pc/j
F1 : baisse du poids corporel à 42 jours ; baisse du nombre de femelles avec des portées viables, diminution des fertilités mâle et femelle ; baisse de la taille des ovaires ou absence complète, baisse du poids des testicules ; augmentation de l’atrophie des tubes séminifères et de leur vacuolisation
F2 : baisse de la taille des portées chez les femelles (aucune portée aux doses supérieures)
≥ 40 mg/kg pc/j / F1 : baisse du poids corporel à 20 jours, atrophie sévère des tubes séminifères
160 mg/kg pc/j : baisse (- 40 %) du nombre de femelles F0 avec des portées viables
F0 : 0 ou 10 mg/kg pc/j, GD7 à GD16, gavage
F1 : accouplement avec mâles non exposés
F0 : aucune toxicité ou effet sur la fertilité rapporté
F1 : diminution du poids des ovaires, nombre faible ou absence de follicules et de corps jaunes
F2 : baisse du nombre de descendants, du nombre de nouveau-nés par portée, du nombre de portées et augmentation de délai entre 2 portées
Rats
0-0,15-0,3-0,6 ou 1,2 mg/kg pc/j, GD14 à GD17, gavage
Aucun effet toxique chez les mères
≥ 0,6 mg/kg pc/j : augmentation des pressions sanguines systolique et diastolique chez les ratons âgés de 53 jours
0 ou 0,3 mg/kg pc/j, GD14 à GD17, gavage
Aucun effet toxique chez les mères ou les nouveau-nés
0-0,02-0,2 ou 2 mg/kg pc/j, PND5 à PND11, gavage
2 mg/kg pc/j : diminution du poids chez les nouveau-nés âgés de 36 et 71 jours
Aucun effet sur différents marqueurs du développement (irruption des incisives, ouverture des yeux ou descente des testicules)
0-5-10 ou 25 mg/kg pc/j, PND1 à PND7, gavage
≥ 10 mg/kg pc/j : diminution du poids des nouveau-nés au 8ème jour (pas de différence au 35ème ou 90ème jour) ; baisse du poids des testicules, des taux de testostérone et de la production de spermatozoïdes
25 mg/kg pc/j : augmentation de la vacuolisation des tubes séminifères
(GD : gestation day ; PND : postnatal day)
Tableau 3. Effets sur le développement du B[a]P pour les générations F1 et F2 de rats et de souris exposées par voie orale [43].
Des effets sur le développement du système nerveux ont aussi été mis en évidence par une batterie de tests neurocomportementaux, suite à des expositions de PND0 à 14 (souris, 0-2 ou 20 mg/kg pc/j, via l’allaitement) ou de PND5 à 11 (rats, 0-0,02-0,2 ou 2 mg/kg pc/j, par gavage), en l’absence de toxicité maternelle et néonatale. Le B[a]P a des effets néfastes sur la mémoire, l’apprentissage et la fonction neuromusculaire et engendre des comportements anxieux. Ces effets sont rapportés dès les plus faibles doses testées [57, 59].
Chez la souris, l’inductibilité du gène (Ah) codant pour l’aryl hydrocarbone hydroxylase joue un rôle particulièrement important dans la fœtotoxicité. L’administration intrapéritonéale de doses de 50 à 300 mg/kg aux jours 7, 10 ou 12 de gestation chez des souris (Ah-) (génotype non inductible) provoque 4 fois moins de résorptions, de morts in utero ou de malformations que chez des souris (Ah+). Par ailleurs, l’injection à des souris (Ah-) des mêmes doses aux jours 7 ou 10 de gestation induit des résultats variables selon le génotype du fœtus : ceux (Ah-) ont un taux de mortalité, de résorption et de malformations (dont pied-bot, hémangiome et fentes palatines) moindre que ceux (Ah+) [60].
L’administration de 100-150 mg/kg ip pendant la gestation moyenne ou tardive chez la souris C3H/Anf induit une suppression marquée et persistante du système immunitaire des petits.
Par inhalation, une augmentation dose-dépendante de la mortalité embryonnaire et fœtale est visible dès l’instillation à la plus faible dose testée chez le rat (0-25-75 ou 100 μg/m3, 4 h/j, GD 11 à 20) : le taux de survie des fœtus/embryons passe de 97 % chez les témoins à 78, 38 et 34 % respectivement [53].
Effets pertubateurs endocriniens
Chez des rats mâles, l’inhalation de 75 μg/m3 de B[a]P (4 h/j, pendant 60 jours) a provoqué une diminution des concentrations plasmatique et intra-testiculaire de testostérone et une augmentation concomitante de l’hormone lutéinisante plasmatique [48, 49]. Ces effets témoignent de l’atteinte des fonctions endocrine et testiculaire par le benzo[a]pyrène. Des effets similaires ont été rapportés chez des rats recevant 0,1 mg/kg pc/j de B[a]P par gavage, pendant 90 jours [44].
Chez les rats femelles exposées dans les mêmes conditions (0-25-75 ou 100 µg/m3, 4 h/j, GD11 à GD20), les taux d’hormones ont été mesurés à GD17. Chez les femelles exposées à 75 µg/m3, une diminution des taux sériques d’œstradiol et de prolactine et une augmentation des concentrations plasmatiques en progestérone ont été détectées [53].
Chez la souris femelle (10 mg/kg/j, gavage tous les 2 jours pendant 60 jours), il induit une diminution des taux d’œstradiol et un prolongement du cycle œstral [50]. Aucun effet n’est rapporté à 5 mg/kg pc/j.
-
Toxicité sur l’Homme
ll existe peu de données sur la toxicité du B[a]P seul. On le retrouve essentiellement au sein de mélanges, avec d’autres HAP. Dans le cadre d’expositions aiguës, les effets du B[a]P sont limités, se résumant principalement à un effet photosensibilisant. Lors d’une exposition chronique, les études épidémiologiques mettent en évidence un excès de mortalité par pathologies cardiovasculaires (cardiopathie ischémique) et respiratoires (BPCO, asthme, emphysème). Divers types de cancers touchant en particulier la peau, le poumon, la vessie, l’œsophage et le système hémato-lymphatique ont été associés à l’exposition chronique professionnelle à des mélanges d’HAP dont le B[a]P. Le B[a]P est génotoxique et est à l’origine de la formation d’adduits à l’ADN. Il entraine une toxicité sur les organes reproducteurs masculins et féminins, sur le développement fœtal, ainsi que des perturbations hormonales.
Toxicité aiguë [61-63]
Aucune donnée concernant l’exposition aiguë d’origine professionnelle n’est disponible dans la littérature. II a seulement été décrit des altérations cutanées au décours d’une série d’applications quotidiennes d’une solution à 1 % de B[a]P, à des fins thérapeutiques, sur la peau de sujets souffrant de diverses dermatoses. Ces manifestations cutanées à type d’érythème, de pigmentation, de desquamation, d’infiltration et même d’hyperkératoses verruqueuses, avaient totalement régressé 2 à 3 mois après l’arrêt du traitement.
Le benzo[a]pyrène est photosensibilisant.
Toxicité chronique [64]
Dans une étude multicentrique européenne réalisée dans une cohorte de 12367 asphalteurs employés entre 1913 et 1999 dans 217 entreprises de travaux routiers, l’exposition moyenne au B[a]P, évaluée sur la base d’une matrice emploi-exposition, était associée à une augmentation significative du risque de mortalité par troubles cardio-vasculaires dès le premier groupe d’exposition (> 68 ng/m3), et par cardiopathies ischémiques dans le groupe le plus fortement exposé (> 272 ng/m3). Malgré l’ajustement sur le tabagisme dans cette étude, d’autres facteurs ont toutefois pu contribuer à cet excès de risque [65].
Deux autres études épidémiologiques ayant analysé la relation potentielle entre la survenue de troubles cardiovasculaires et l’exposition aux émissions de bitumes n’ont pas permis de confirmer cette association. Dans cette même cohorte européenne, une autre étude a mis en évidence une augmentation significative du risque de mortalité par pathologies respiratoires non malignes (BPCO, emphysème et asthme), corrélée à l’indice d’exposition cumulée (mais pas à l’exposition moyenne) au B[a]P. Le risque était statistiquement augmenté dès le premier groupe d’exposition (233 à 624 ng/m3/an) [66].
Une étude canadienne réalisée dans une cohorte de 7026 travailleurs en fonderie d’aluminium retrouve une association significative entre la mortalité par cardiopathie ischémique et l’exposition cumulée au B[a]P pour les expositions les plus élevées (> 66,7 µg/m3/an), après ajustement sur le tabagisme. Aucune association n’est mise en évidence entre l’exposition cumulée au B[a]P et la mortalité par pathologies pulmonaires chroniques obstructives et par maladies vasculaires cérébrales. Dans cette étude également, les travailleurs ont été exposés à d’autres nuisances (chimiques ou autres) [67].
Effets génotoxiques [3]
Aucune étude n’a évalué le potentiel génotoxique du benzo[a]pyrène seul chez l’homme, quelle que soit la voie d’exposition.
Des adduits B[a]P-ADN ont été mis en évidence au niveau des leucocytes circulants de salariés de fonderies de fer finlandais, exposés à des mélanges de HAP contenant notamment du B[a]P. Les taux d’adduits augmentaient avec les concentrations atmosphériques individuelles de B[a]P, celles-ci étant comprises entre 2 et 60 ng/m3 [68].
Une augmentation des taux sanguins (sur lymphocytes circulants) d’adduits B[a]P-ADN a été mise en évidence chez des pompistes sud-africains comparativement à des témoins, même après ajustement sur le tabagisme. Aucune information n’est disponible concernant les niveaux d’exposition au B[a]P et les autres sources d’exposition extra-professionnelles [69].
Effets cancérogènes [28, 70-71]
Aucune information sur le caractère cancérigène du benzo[a]pyrène seul n’est disponible chez l’Homme.
Néanmoins, les expositions à des mélanges contenant du benzo[a]pyrène ont été associées à une série de cancers dans divers secteurs professionnels, notamment :
- production de coke : cancers du poumon ;
- gazéification du charbon : cancers du poumon et de la vessie ;
- travaux de dallage et de couvertures de toits à l’aide de brais de houille : cancers du poumon ;
- distillation de goudron de houille : cancers de la peau ;
- travaux de ramonage exposant à des suies : cancers du poumon, de l’œsophage, du système hémato-lymphatique et de la peau ;
- fonderie d'aluminium : cancers du poumon et de la vessie.
Par ailleurs, des cancers du poumon, de la lèvre, de la cavité buccale, du pharynx, de l’œsophage, du larynx et de la vessie sont observés dans le cadre du tabagisme.
Le CIRC a considéré l’ensemble de ces données, les résultats des études expérimentales réalisées chez l’animal, ainsi que les données mécanistiques pour classer le B[a]P dans le groupe 1 des substances cancérogènes pour l’Homme.
Les cancers cutanés liés aux HAP en général et au B[a]P en particulier surviennent sur les zones exposées, après contacts répétés, et sont souvent précédés de lésions hyperkératosiques. Ce sont des carcinomes épithélioïdes, en général spinocellulaires.
Effets sur la reproduction
-
Reproduction masculine [72]
Une étude réalisée chez des ouvriers de fours à coke trouve une plus grande fréquence d’oligospermie et le double d’anomalies morphologiques des spermatozoïdes chez les ouvriers les plus exposés comparés aux ouvriers moins exposés aux HAP. L’exposition des salariés à des températures élevées, pourrait néanmoins avoir contribué aux effets observés sur les paramètres spermatiques [73].
Une association négative entre la mobilité spermatique et le taux d’adduits B[a]P-ADN dans les spermatozoïdes a été mise en évidence chez 86 volontaires issus de la population sicilienne [74. Dans une autre étude italienne réalisée chez 205 hommes exposés professionnellement aux HAP et suivis pour infertilité, le taux d’adduits HAP-ADN était significativement associé à des anomalies de la tête des spermatozoïdes [75].
-
Reproduction féminine [72]
Dans une étude réalisée chez 36 patientes bénéficiant d’un protocole de fécondation in vitro, les concentrations de B[a]P dans le liquide folliculaire étaient plus élevées dans le groupe des patientes fumeuses, et chez les patientes n’ayant pas réussi à concevoir par rapport à celles ayant réussi [76].
Une association entre les taux sanguins de B[a]P et l’insuffisance ovarienne prématurée (IOP) a été mise en évidence dans une étude chinoise de type cas-témoins (157 patientes atteintes d’IOP et 217 témoins) [77].
-
Développement [72]
Une forte association entre les taux sanguins d’adduits B[a]P-ADN et les avortements spontanés (survenus avant la 14e semaine de grossesse) a été mise en évidence dans une étude chinoise de type cas-témoins (81 cas et 81 témoins) [78].
Dans une étude de cohorte chinoise (150 couples mères-enfants vivant à proximité d’une centrale à charbon), une association négative a été mise en évidence entre les taux sanguins (sang du cordon ombilical) d’adduits B[a]P-ADN et le périmètre crânien des nouveau-nés ainsi que le poids des nourrissons à l’âge de 18, 24 et 30 mois. Une association négative était également mise en évidence entre la durée d’exposition prénatale et le poids et la taille des nourrissons à l’âge de 18, 24 et 30 mois [79]. Une autre étude réalisée sur la même cohorte a mis en évidence une association entre les taux sanguins (sang du cordon ombilical) d’adduits B[a]P-ADN et le développement des fonctions motrices et cognitives des nourrissons âgés de 2 ans. L’exposition au plomb pourrait toutefois avoir contribué à l’effet observé [80].
-
Effets perturbateur endocrinien [81]
Dans une étude chinoise de type cas-témoin, où une association entre les taux sanguins de BaP et l’insuffisance ovarienne prématurée (IOP) avait été mise en évidence, les taux sanguins de FSH, LH et hormone anti-Müllérienne (AMH) étaient corrélés à celui du B[a]P : positivement pour FSH et LH et négativement pour AMH [77].
Le benzo[a]pyrène est classé par l’ANSES dans le groupe II : perturbateur endocrinien présumé.
-
Interférences métaboliques
-
Cohérence des réponses biologiques chez l'homme et l'animal
